题目内容
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
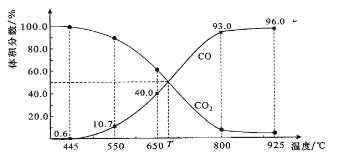
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
【答案】B
【解析】
试题分析:A、可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v逆均减小,又该反应是气体体积增大的反应,则平衡正向移动,故A错误;B、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)![]() 2CO(g)
2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以![]() ×100%=40%,解得x=0.25mol,则CO2的转化率为
×100%=40%,解得x=0.25mol,则CO2的转化率为![]() ×100%=25%,故B正确;C、由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;D、925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=
×100%=25%,故B正确;C、由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;D、925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() =
=![]() =23.0P,故D错误;故选B。
=23.0P,故D错误;故选B。

练习册系列答案
相关题目