题目内容
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
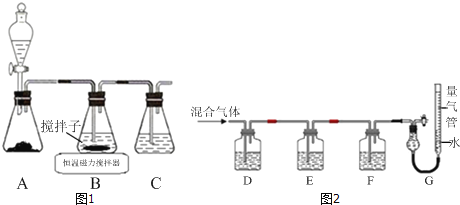
[甲方案]:如图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
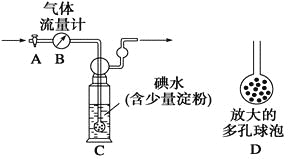
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
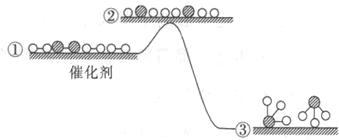
[乙方案]:实验步骤如下面流程图所示:

(3)步骤①中过量H2O2的作用是________________________________________
(4)写出步骤②中反应的化学方程式_______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是________________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为__________________________(用含有V、m的代数式表示)。
【答案】增大气体与溶液的接触面积,有利于SO2与碘水反应 偏低 使SO2完全转化为SO42- H2SO4+Ba(OH)2=BaSO4↓+2H2O 静置分层后,往上层溶液中继续滴加Ba(OH)2溶液,若无浑浊现象产生,则Ba(OH)2已足量,反之不足 ![]() 或
或![]() ×100%
×100%
【解析】
甲方案利用的原理为:I2+SO2+2H2O=H2SO4+2HI,最后测定剩余气体的体积,进而定尾气中二氧化硫的含量。
乙方案利用的原理为:SO2+H2O2 =H2SO4,Ba (OH)2+ H2SO4=BaSO4↓+ 2H2O,最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
(3)由方案原理可知,H2O2是将SO2完全转化为SO42-;
(4)步骤②中反应的化学方程式为: Ba (OH)2+ H2SO4=BaSO4↓+ 2H2O;
(5)步骤②中Ba (OH)2是否足量的判断方法是:静置分层后,向上层清液中继续滴加Ba (OH)2溶液,若无浑浊现象产生说明Ba (OH)2足量,否则不足;
(6)mg是硫酸钡的质量,硫酸钡的物质的量为n(BaSO4)= ![]() mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)=
mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)= ![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故尾气中二氧化硫的体积分数是
L,故尾气中二氧化硫的体积分数是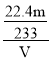 =
=![]() 。
。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
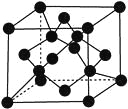
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。