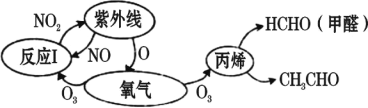
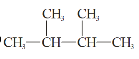题目内容
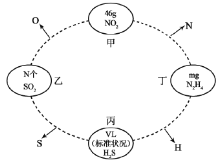
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是
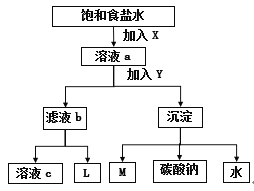
A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
【答案】D
【解析】
A.联合制碱法与氨碱法其原理都是NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+H2O+CO2↑,NH3极易溶于水且溶液呈弱碱性,再通入CO2使之更多地转化为HCO3-,故工业上可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3,所以X是NH3,Y是CO2,故A正确;B.图中的沉淀为碳酸氢钠,碳酸氢钠受热分解2NaHCO3
Na2CO3+H2O+CO2↑,NH3极易溶于水且溶液呈弱碱性,再通入CO2使之更多地转化为HCO3-,故工业上可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3,所以X是NH3,Y是CO2,故A正确;B.图中的沉淀为碳酸氢钠,碳酸氢钠受热分解2NaHCO3![]() Na2CO3+H2O+CO2↑,M为二氧化碳,二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故B正确;C.若是联碱法,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,所以L的主要成分是氯化铵,故C正确;D.先使氨气X通入饱和食盐水中而成氨盐水,再通入二氧化碳Y生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,含有氯化铵的滤液b与石灰乳混合加热,CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2
Na2CO3+H2O+CO2↑,M为二氧化碳,二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故B正确;C.若是联碱法,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,所以L的主要成分是氯化铵,故C正确;D.先使氨气X通入饱和食盐水中而成氨盐水,再通入二氧化碳Y生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,含有氯化铵的滤液b与石灰乳混合加热,CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,所放出的氨气L可回收循环使用,故D错误;故答案为D。
CaCl2+2NH3↑+2H2O,所放出的氨气L可回收循环使用,故D错误;故答案为D。

 智慧小复习系列答案
智慧小复习系列答案【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,可用作分析试剂及鞣革的还原剂,易溶于水,受热、遇酸易分解。Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。
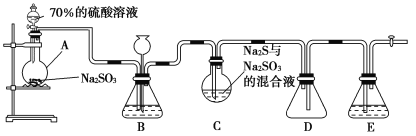
烧瓶C中发生如下反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ①
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ②
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) ③
Na2S2O3(aq) ③
Ⅰ.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_________;装置D的作用是______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用________(填字母)。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_________;所制得的粗产品可以通过________方法进一步提纯得到纯Na2S2O3·5H2O。
Ⅱ.测定产品纯度
准确称取w g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10 mol·L-1I2的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
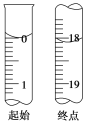
(3)滴定至终点时的现象:______________。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为________mL。产品的纯度为________(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。
Ⅲ.探究Na2S2O3的部分化学性质
(4)(提出假设)
假设一:Na2S2O3与Na2SO4的结构相似,化学性质也应该相似,因此,室温时Na2S2O3溶液的pH=7。
假设二:从S的化合价推测Na2S2O3具有较强的还原性。
(验证假设) 配制适量Na2S2O3溶液,进行如下实验,请将实验补充完整。
实验操作 | 实验结论 或现象 | 现象解释(用离子 方程式表示) | |
假设一 | ________ | 溶液pH=8 | ________ |
假设二 | 向溴水中 滴入适量 Na2S2O3 溶液 | 溴水褪色 | ________ |
实验结论:________________________________________。
Ⅳ.Na2S2O3的应用
(5)Na2S2O3的商品名为“海波”,俗称“大苏打”,化学上常用于滴定实验。为测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00 mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量稀H2SO4,滴加几滴指示剂,用0.10 mol·L-1 Na2S2O3标准溶液滴定至终点,进行3次平行实验后,测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7)=________mol·L-1。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-)
Ⅴ.探究与反思
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将实验方案补充完整。
取适量产品配成稀溶液,___________________(所需试剂从BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)。
【题目】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
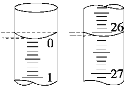
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.50 | |
第二次 | 25.00 | 1.56 | 30.30 | |
第三次 | 25.00 | 0.22 | 26.76 | |
依据上表数据列式计算该NaOH溶液的物质的量浓度______________。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
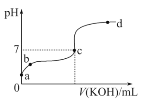
(1)c点溶液中的离子浓度大小顺序为________________。
(2)a、b、c三点中水的电离程度最大的是________。