题目内容
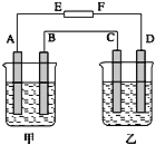
【题目】如下图所示,甲烧杯中盛有100mL0.50molL-1AgNO3溶液,乙烧杯中盛有100mL0.25molL-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重3.8g,求此时甲、乙装置中共产生多少升气体?(标准状况下)
【答案】
0.84L
【解析】本题主要考查有关电解的计算。
电解池中,发现A极比C极重3.8g,则A极是阴极,电极反应式为:Ag++e-=Ag,C是阴极,电极反应为:Cu2++2e-=Cu。设电路中转移电子的物质的量是xmol,则108x-32x=3.8,所以x=0.05。
B是阳极,电极反应为:4OH--4e-═H2O+O2↑,转移电子0.05mol,则生成氧气0.0125mol,氧气的体积是0.28L。D是阳极,电极反应为:2Cl--2e-=Cl2↑,转移电子0.05mol,则生成氯气0.025mol,氯气的体积是0.56L。故共产生气体0.28L+0.56L=0.84L。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


