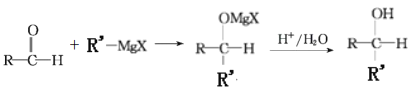
题目内容
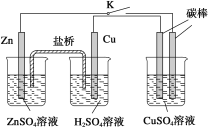
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
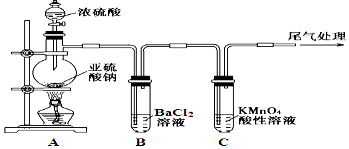
已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是 。
(2) 实验过程中,C中的现象是 ,说明SO2具有 性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:
![]()
根据实验事实判断该白色沉淀的成分是 (填化学式),产生该白色沉淀的原因可能是 (填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由
【答案】(1)分液漏斗(2)KMnO4溶液退色 还原
(3)BaSO4 bd
(4)有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体
【解析】
试题分析:A装置利用Na2SO3和浓硫酸的反应制备SO2,浓硫酸装在分液漏斗中,SO2通入KMnO4酸性溶液中褪色,说明SO2具有还原性;SO2通入BaCl2溶液中,B中出现了明显的白色沉淀,不溶于稀盐酸,该白色沉淀应为BaSO4;而不是BaSO3,因为BaSO3能够与稀盐酸反应,但是BaCl2溶液中可能溶解有氧气,把BaSO3氧化为BaSO4;也可能是制得的SO2气体中可能混有氧气,把BaSO3氧化为BaSO4 答案bd;浓HNO3具有强氧化性,把,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体,或反应生成SO2气体氧化为硫酸;

【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
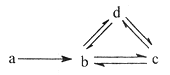
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
A.①② B.②③ C.③④ D.②④