题目内容
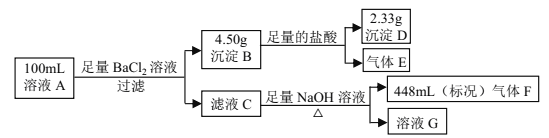
【题目】I某课外小组模拟工业流程,设计了如下实验装置制备硝酸。
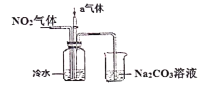
(1)通入的气体a是________(填化学式),通入a的目的是:_________。
(2)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是: ______NO2+ ______Na2CO3+______ H2O= ______ NaNO2+ ______ + ______NaHCO3
(3)用N2O4代替NO2与水和a气体反应可生成硝酸,此反应的化学方程式是:_________________
Ⅱ按如图装置进行NH3性质实验。
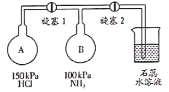
(4)先打开旋塞1,B瓶中的现象是_____________;原因是__________________。稳定后,关闭旋塞1。
(5)再打开旋塞2,B瓶中的现象是____________________________________。
【答案】O2 提高NO2的转化率 2 2 1 13 NaNO 2 2N2O4+O2+2H2O=4HNO3 产生白色的烟 A瓶中压强比B瓶中压强大,打开旋塞1,HCl进入B瓶并与NH3混合,发生反应HCl+NH3===NH4Cl,生成的NH4Cl为白色固体小颗粒 烧杯中的石蕊水溶液倒吸进入到B瓶中,溶液显红色.
【解析】
根据实验目的及实验装置分析装置中发生的反应,书写化学方程式;根据实验原理及物质的性质分析实验的现象。
(1)二氧化氮与水反应生成硝酸和一氧化氮,一氧化氮能和氧气反应生成二氧化氮,所以通入的气体a是O2;通入a的目的是:提高NO2的转化率,
故答案为:O2;提高NO2的转化率;
(2)尾气是二氧化氮,与碳酸钠溶液发生氧化还原反应,生成硝酸钠与亚硝酸钠,根据得失电子守恒配平得:2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3,
故答案为: 2;2;1;1;NaNO3;2;
(3)N2O4与NO2可以相互转化,化学性质相似,反应的化学方程式是:2N2O4+O2+2H2O=4HNO3,
故答案为:2N2O4+O2+2H2O=4HNO3;
(4)根据装置特点,先打开旋塞1,氯化氢与氨气反应生成氯化铵,则B瓶中的现象是产生白色的烟;原因是A瓶中压强比B瓶中压强大,打开旋塞1,HCl进入B瓶并与NH3混合,发生反应HCl+NH3===NH4Cl,生成的NH4Cl为白色固体小颗粒;
故答案为:产生白色的烟;A瓶中压强比B瓶中压强大,打开旋塞1,HCl进入B瓶并与NH3混合,发生反应HCl+NH3===NH4Cl,生成的NH4Cl为白色固体小颗粒;
(5)氨气极易溶于水,且水溶液呈碱性,所以打开旋塞2,B瓶中的现象是烧杯中的石蕊水溶液倒吸进入到B瓶中,溶液显红色,
故答案为: 烧杯中的石蕊水溶液倒吸进入到B瓶中,溶液显红色。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案