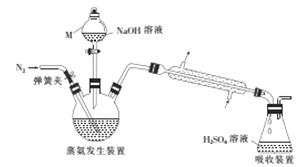
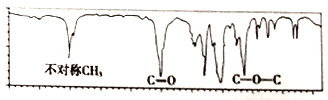
题目内容
【题目】下列哪一个反应表示二氧化硫被还原 ( )
A.SO2+2H2O+Cl2=H2SO4+2HCl
B.SO2+2H2S=2H2O+3S
C.SO2+2NaOH=Na2SO3+H2O
D.SO2+Na2CO3=Na2SO3+CO2↑
【答案】B
【解析】A项,SO2中硫元素的化合价由+4价升高为+6价,SO2被氧化;
B项,SO2中硫元素的化合价由+4价降低为0价,SO2被还原;
C项,元素化合价没有变化,不是氧化还原反应,SO2既未被氧化也未被还原;
D项,元素化合价没有变化,不是氧化还原反应,SO2既未被氧化也未被还原。
故答案为:B
二氧化硫被还原,则二氧化硫中硫元素的化合价将会降低,据此判断即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目