题目内容
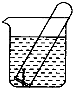 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:(1)铁钉在逐渐生绣.
(2)若试管内液面上升,发生
吸氧
吸氧
腐蚀,电极反应:负极:Fe-2e-=Fe2+
Fe-2e-=Fe2+
,正极:2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
(3)若试管内液面下降,则原溶液呈
酸
酸
性,发生的电极反应:负极:Fe-2e-=Fe2+
Fe-2e-=Fe2+
,正极:4H++4e-=2H2↑
4H++4e-=2H2↑
.分析:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
(2)若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,
故答案为:吸氧,Fe-2e-=Fe2+,2H2O+O2+4e-=4OH-;
(3)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:
4H++4e-=2H2↑,
故答案为:酸,Fe-2e-=Fe2+,4H++4e-=2H2↑.
(2)若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,
故答案为:吸氧,Fe-2e-=Fe2+,2H2O+O2+4e-=4OH-;
(3)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:
4H++4e-=2H2↑,
故答案为:酸,Fe-2e-=Fe2+,4H++4e-=2H2↑.
点评:本题考查了钢铁的电化学腐蚀,注意酸性条件下,钢铁发生析氢腐蚀,弱酸性或中性条件下,钢铁发生吸氧腐蚀.

练习册系列答案
相关题目
 如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、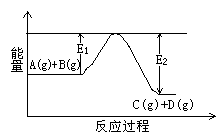

 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
0(填“>”、“<”、
