题目内容
下列有关实验操作、现象或实验原理叙述错误的是( )
| A.在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度 |
| B.纸层析法分离Fe3+和Cu2+ 的实验中,点样后的滤纸无需晾干就可将其浸入展开剂中 |
| C.将KNO3和NaCl的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
B
试题分析:A.氢氧化钠和盐酸混合反应后的最高温度应是完全反应时的温度,否则会引起较大误差,故A正确;B.原理是将含有Cu2+和Fe3+的溶液涂在滤纸一端,并在这一端用丙酮作展开剂,在滤纸的毛细作用下,展开剂携带待分离的物质沿滤纸纤维向上移动。由于Cu2+和Fe3+的移动速度不同,一段时间后,Cu2+和Fe3+距起点的距离会不同,从而达到分离的目的。Cu2+和Fe3+可用氨熏显色。载体是纸,固定相是水,流动相是展开剂;晾干以保证每点在纸上扩散的直径不至于太大,否则各组分移动的时候会相互重叠,导致分离不充分,影响实验结果,故B错误;C.KNO3溶解度受温度的影响较大,如不趁热过滤,NaCl晶体会含有较多KNO3杂质,故C正确;D.锌与铁在酸溶液中发生原电池反应,速率较大,锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,故D正确。

练习册系列答案
相关题目
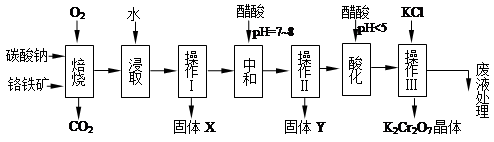
 8Na2CrO4+2 Fe2O3+8CO2↑;
8Na2CrO4+2 Fe2O3+8CO2↑; 2CrO42-+2H+
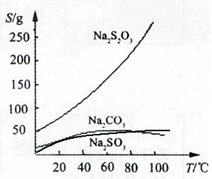
2CrO42-+2H+ Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。