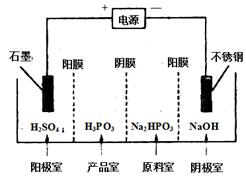
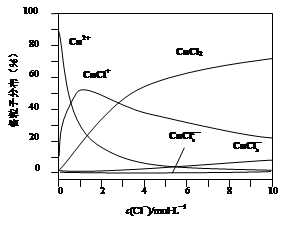题目内容
(8分)将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。
(1)2;16;2;2;5;8;(2)HCl;0.5mol;(3)0.2;0.16;(4)12g
试题分析:(1)根据氧化还原反应中化合价升降总数相等可得KMnO4与浓盐酸反应的方程式是2KMnO4+16HCl="2HCl+" 2MnCl2+5Cl2↑+8H2O;(2)在上述反应中浓盐酸中的Cl失去电子,化合价升高,所以还原剂是HCl;每产生氧化产物5mol的氯气,电子转移10mol,所以当还原剂失去1mol电子时,氧化产物的物质的量为0.5mol;(3)若0.08mol KMnO4完全发生上述反应则产生氯气0.2mol,若KMnO4完全发生分解反应产生氧气:2KMnO4△ K2MnO4+MnO2+ O2↑则根据方程式可知可产生0.04mol。所以a +b的最大值为0.2mol。若KMnO4完全分解,则产生氧气0.04mol,得到的K2MnO4和MnO2都是0.04mol,它们与浓盐酸反应都能产生的Cl2,反应方程式是K2MnO4+8HCl=2KCl+MnCl2+2Cl2↑+4H2O;MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O.则它们产生的氯气的物质的分别是:0.08mol、0.04mol,所以一共产生气体的物质的量是0.04+0.08+0.04=0.16mol。因此a +b最小值为0.16mol.若a +b =0.18时,产生amol的氧气,分解KMnO4为2amol,还含有未分解KMnO4为(0.08-2a)mol, K2MnO4和MnO2物质的量是amol,则根据Mn得到的电子与O、Cl失去的电子数目相等可得Cl2的物质的量是[(0.08-2a) ×5 +a×4+a×2]÷2=b.由于a +b =0.18,所以a+[(0.08-2a)×5+a×4+a×2]÷2=0.18。解得a=0.02,所以所得到的固体质量是12.64g-0.02×32g=12g.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
 >Cl2>Fe3+ >I2
>Cl2>Fe3+ >I2 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe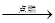 2FeCl3
2FeCl3