题目内容
10. 根据方程式回答相关问题:Fe+2HCl═FeCl2+H2↑
根据方程式回答相关问题:Fe+2HCl═FeCl2+H2↑(1)该化学反应能否设计成原电池?能(填“能”或“不能”),为什么:为自发进行的氧化还原反应;
(2)请你画出你设计的原电池结构图,并写出电极材料的名称和电解质名称.
材料的名称:负极铁,正极铜;
电解质溶:盐酸;
在图中画出你设计的装置简图
(3)电极反应式:负极Fe-2e-═Fe2+,正极2H++2e-═H2↑;
(4)电子从负极流向正极,电流从正极流向负极(填“正”或“负”).
分析 反应Fe+2HCl═FeCl2+H2↑中,Fe被氧化,HCl被还原,为氧化还原反应,可设计成原电池,在原电池反应中,负极为铁,发生氧化反应生成Fe2+,正极可为石墨、铜等,发生还原反应生成H2,电解质为HCl,原电池工作时,电流由正极经导线流向负极,电子流向与电流相反,以此解答该题.
解答 解:(1)发生氧化还原反应,且放热反应,可设计成原电池,故答案为:能;为自发进行的氧化还原反应;
(2)在原电池反应中,负极为铁,发生氧化反应生成Fe2+,正极可为石墨、铜等,发生还原反应生成H2,电解质为HCl,装置为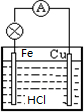 ,
,
故答案为:铁;铜;盐酸; ;
;
(3)负极电极方程式为Fe-2e-═Fe2+,正极为2H++2e-═H2↑,故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(4)原电池工作时,电流由正极经导线流向负极,电子流向与电流相反,
故答案为:负;正;正;负.
点评 本题考查了原电池工作原理、原电池装置图的设计,题目难度中等,注意掌握原电池工作原理,能够根据反应原理画出正确的原电池装置图.

练习册系列答案
相关题目
20.一种荧光氨基酸的结构简式如图所示,有关该化合物的说法正确的是( )


| A. | 分子中含有2个手性碳原子 | |
| B. | 能与强酸反应 | |
| C. | 1mol该有机物最多可与1molBr2发生反应 | |
| D. | 1mol该有机物最多可与含4molNaOH的溶液反应 |
1.某同学欲配制含下列不同阴、阳离子的混合溶液,其中能配制成功的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | NH4+、I-、K+、OH- | D. | Cu2+、Na+、S2-、SO42- |
15.微粒Mn-的核外电数为x,质量数为A,则M原子核内的中子数为( )
| A. | A-x+n | B. | A-x | C. | A-x-n | D. | A-N |
20.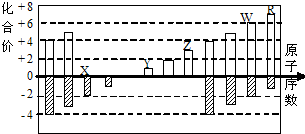 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图
(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
| A. | 离子半径比较:W>R>X>Y>Z | |
| B. | W的气态氢化物的还原性和稳定性均弱于R的氢化物 | |
| C. | 工业上电解熔融的ZR3制备Z单质 | |
| D. | 含Y元素的盐溶液可能显酸性 |
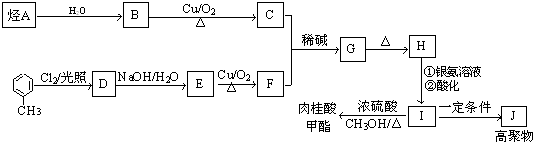
 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$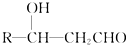 $→_{△}^{-H_{2}O}$RCH=CHCHO
$→_{△}^{-H_{2}O}$RCH=CHCHO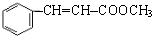 ;J的结构简式为
;J的结构简式为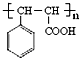 ;
; 、
、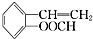 、
、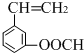 、
、 .
.