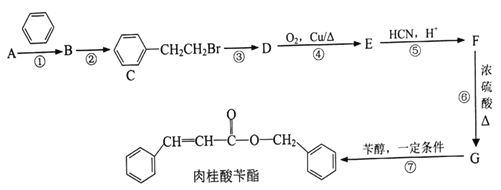
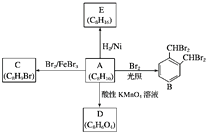
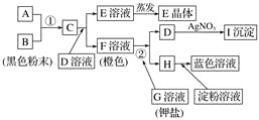
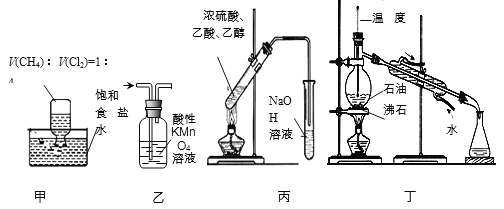
��Ŀ����
����Ŀ���п�ѧ��Ԥ�ԣ����ܽ���Ϊ21���͵���Ҫ��Դ��������һ���������ɫ��Դ��
��1����101kPa�£�1g������ȫȼ������Һ̬ˮ�ų�142.9kJ��������
�ٸ÷�Ӧ�ķ�Ӧ��������_____����������������������������С������������������
�ڸ÷�Ӧ���Ȼ�ѧ����ʽΪ_______________________��
��2����lmol������ȫȼ������lmol��̬ˮ�ų�241kJ��������
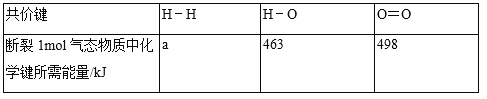
���������aΪ_____
��3��̿����ˮ������Ӧ����CO��g���ͱ�״����22.4LH2��g������131.5kJ��������д���Ȼ�ѧ����ʽ��_____________��
��4����ͬһ��Ӧ��������״̬��ͬʱ��A(g)��B(g)��C(g)����H1<0��A(g)��B(g)��C(l)����H2<0������H1____��H2��
���𰸡����� H2(g)+1/2O2(g)=H2O(l) ��H=-285.8 kJ�� mol��1 436 C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.5 kJ�� mol��1 ��
��������
��1���ٷ�Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ����������������������������
�ڸ������ʵ����ʵ����뷴Ӧ�ȳ����ȣ��Ȼ�ѧ����ʽ����дҪ��ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ䣻
��2����ѧ��Ӧ�ų�������=�¼������ͷŵ�����-�ɼ��������յ�������
��3�����ȡ�HΪ��ֵ��
��4����������Һ��Ҫ���ȣ���H2�ľ���ֵ��������H1>��H2��
��1���ٷ�Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ����������������������������
����298K��101kPaʱ��1g��0.5molH2��ȫȼ������Һ̬ˮ���ų�142.9kJ��������1molH2��ȫȼ������Һ̬ˮ���ų�142.9kJ��2=285.8kJ��������������ȼ����Ϊ285.8 kJ��mol��1�����ʾH2ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ��mol��1����H2(g)+1/2O2(g)=H2O(l) ��H=-285.8 kJ�� mol��1��
��2����1mol������ȫȼ������1mol��̬ˮ�ų�241kJ����������֪H-O����Ϊ463kJ��mol��1��O=O����Ϊ498kJ��mol��1��ȼ�յ��Ȼ�ѧ����ʽ��2H2��g��+O2��g���T2H2O��g����H=-484kJ��mol��1����1mol H-H����ȫ����ʱ��������ΪX kJ��2X+498KJ-4��463KJ=-482kJ�����X=436KJ��
��3��̿����ˮ������Ӧ����CO��g���ͱ�״����22.4LH2��g������131.5kJ�����������ȡ�HΪ��ֵ���Ȼ�ѧ����ʽ��C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.5 kJ�� mol��1��
��4����ͬһ��Ӧ��������״̬��ͬʱ��A(g)��B(g)��C(g)����H1<0��A(g)��B(g)��C(l)����H2<0����������Һ��Ҫ���ȣ���H2�ľ���ֵ��������H1>��H2��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ��ʯ��ɽ�д�����ɽˮ�ֳ�����������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
(1)SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2��
��֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)= NH4HSO3(aq) ��H1=a kJ/mol��
��NH3��H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2=b kJ/mol��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3=c kJ/mol��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)����H=______kJ/mol��
(2)ȼú���糧�����÷�Ӧ2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ��/min Ũ��/mol��L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
��0��10 min�ڣ�ƽ����Ӧ����v(SO2)=_____mol/(L��min)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������_____������ĸ����
A��ͨ��һ������O2 B������һ�����ķ�״̼���
C���ʵ���С��������� D��������ʵĴ���
(3)NOx���ŷ���Ҫ����������β�����������÷�ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��
N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��
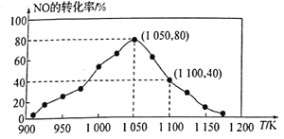
��ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����{��������ԭ��Ϊ_______����1100Kʱ��CO2���������Ϊ______��
(4)��ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp������1050K��1.1��106 Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=____[��֪�������ѹ(P��)=������ѹ(P)���������]��
(5)����β���������÷�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���____���>����<����=����k������ı�����
������1L���ܱ������г���1 molCO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk��=_____��