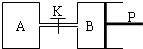题目内容
图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计).在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL.
2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL.(1)B中N2的转化率是 .A中N2的转化率 (填“大于”、“等于”或“小于”)B中N2的转化率.理由是 .
(2)打开K,一段时间后反应再次达到平衡,则B的体积为 .请说明理由?
(3)A反应达到平衡时,放出akJ的热量,若向A中充入2molNH3,在相同条件下达到平衡时吸收热量为bkJ,则a和b的关系是 .
(4)B中反应达到平衡后,只改变下列条件,c(NH3)不改变的是 (填序号).
A.升高温度
B.向容器充入1molAr(g)
C.向容器中充入2molNH3
D.选用效果更好的催化剂.

【答案】分析:(1)B为恒温恒压,利用体积之比等于物质的量之比,求出平衡时B中混合气体的物质的量,令转化的氮气的物质的量为xmol,利用三段式列方程求出,再利用转化率的定义计算氮气的转化率;A容积不变,而B容积缩小,A中容器压强小于B中压强,平衡向逆反应方向移动;
(2)打开K达到平衡时,平衡体系的组成与原B容器中相同,物质的转化率相同,平衡时各组分的含量相同;
(3)向A中充入2molNH3与向容器A中充入1molN2和3molH2为等效平衡,到达平衡时各组分的量对应相等,令平衡时氮气的物质的量为ymol,根据热化学方程式求出a、b,据此解答;
(4)A.升高温度,平衡向吸热方向移动,即向逆反应,平衡常数减小;
B.向容器充入1molAr(g),体积增大;
C.向容器中充入2molNH3,与原平衡等效;
D.选用效果更好的催化剂,平衡状态不移动.
解答:解:(1)B为恒温恒压,反应前后体积之比等于物质的量之比,令平衡后B中混合气体的物质的量为n,则:
0.8aL:0.6aL=4mol:n,解答n=3mol,
N2(g)+3H2(g) 2NH3(g);
2NH3(g);
开始:1mol 3mol 0mol
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
所以:(1-x)mol+(3-3x)mol+2xmol=3mol,
解得x=0.5,
N2的转化率为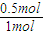 ×100%=50%;
×100%=50%;
A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动,N2的转化率小于B中N2的转化率.
故答案为:50%;小于;A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动;
(2)打开K达到的平衡,可等效为开始打开K达到的平衡,与原B中平衡等效,氮气的转化率相同,氮气物质的量变为2mol,NH3的物质的量为原B中2倍,平衡体系的组成与原B容器中相同,平衡时各组分的含量不变,此时容器内混合气体的物质的量为原B中2倍,体积之比等于物质的量之比,容器的总体积为原B平衡时体积的2倍,即1.2aL,故此时B的体积1.2aL-aL=0.2aL,故答案为:0.2aL 打开K达到平衡时,平衡体系的组成与原B容器中相同,此时容器的总体积为原B平衡时体积的2倍,即1.2aL,故B的体积0.2aL;
(3)向A中充入2molNH3与向容器A中充入1molN2和3molH2为等效平衡,到达平衡时各组分的量对应相等,令平衡时氮气的物质的量为ymol,
向容器A中充入1molN2和3molH2,平衡时参加反应的氮气为(1-y)mol,根据N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol,可知放出的热量为(1-y)mol×92.4kJ/mol=92.4(1-y)kJ,即a=92.4(1-y),
2NH3(g);△H=-92.4kJ/mol,可知放出的热量为(1-y)mol×92.4kJ/mol=92.4(1-y)kJ,即a=92.4(1-y),
向A中充入2molNH3,到达平衡时,生成氮气ymol,根据N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol,可知吸收的热量为ymol×92.4kJ/mol=92.4ykJ,即b=92.4y.所以a+b=92.4(1-y)+92.4y=92.4,故答案为:a+b=92.4;
2NH3(g);△H=-92.4kJ/mol,可知吸收的热量为ymol×92.4kJ/mol=92.4ykJ,即b=92.4y.所以a+b=92.4(1-y)+92.4y=92.4,故答案为:a+b=92.4;
(4)A.升高温度,平衡向吸热方向移动,即向逆反应,c(NH3)减小,故A错误;
B.向容器充入1molAr(g),体积增大,等效为减小压强,平衡向逆反应移动,c(NH3)减小,故B错误;
C.向容器中充入2molNH3,与原平衡等效,c(NH3)不变,故C正确;
D.选用效果更好的催化剂,平衡状态不移动,c(NH3)不变,故D正确.
故选:CD.
点评:本题主要考查化学平衡计算,难度较大,注意等效平衡的利用是解题的关键.
(2)打开K达到平衡时,平衡体系的组成与原B容器中相同,物质的转化率相同,平衡时各组分的含量相同;
(3)向A中充入2molNH3与向容器A中充入1molN2和3molH2为等效平衡,到达平衡时各组分的量对应相等,令平衡时氮气的物质的量为ymol,根据热化学方程式求出a、b,据此解答;
(4)A.升高温度,平衡向吸热方向移动,即向逆反应,平衡常数减小;
B.向容器充入1molAr(g),体积增大;
C.向容器中充入2molNH3,与原平衡等效;
D.选用效果更好的催化剂,平衡状态不移动.
解答:解:(1)B为恒温恒压,反应前后体积之比等于物质的量之比,令平衡后B中混合气体的物质的量为n,则:
0.8aL:0.6aL=4mol:n,解答n=3mol,
N2(g)+3H2(g)
 2NH3(g);
2NH3(g);开始:1mol 3mol 0mol
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
所以:(1-x)mol+(3-3x)mol+2xmol=3mol,
解得x=0.5,
N2的转化率为
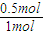 ×100%=50%;
×100%=50%;A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动,N2的转化率小于B中N2的转化率.
故答案为:50%;小于;A容积不变,而B容积缩小,所以A中容器压强小于B中压强,平衡向逆反应方向移动;
(2)打开K达到的平衡,可等效为开始打开K达到的平衡,与原B中平衡等效,氮气的转化率相同,氮气物质的量变为2mol,NH3的物质的量为原B中2倍,平衡体系的组成与原B容器中相同,平衡时各组分的含量不变,此时容器内混合气体的物质的量为原B中2倍,体积之比等于物质的量之比,容器的总体积为原B平衡时体积的2倍,即1.2aL,故此时B的体积1.2aL-aL=0.2aL,故答案为:0.2aL 打开K达到平衡时,平衡体系的组成与原B容器中相同,此时容器的总体积为原B平衡时体积的2倍,即1.2aL,故B的体积0.2aL;
(3)向A中充入2molNH3与向容器A中充入1molN2和3molH2为等效平衡,到达平衡时各组分的量对应相等,令平衡时氮气的物质的量为ymol,
向容器A中充入1molN2和3molH2,平衡时参加反应的氮气为(1-y)mol,根据N2(g)+3H2(g)
 2NH3(g);△H=-92.4kJ/mol,可知放出的热量为(1-y)mol×92.4kJ/mol=92.4(1-y)kJ,即a=92.4(1-y),
2NH3(g);△H=-92.4kJ/mol,可知放出的热量为(1-y)mol×92.4kJ/mol=92.4(1-y)kJ,即a=92.4(1-y),向A中充入2molNH3,到达平衡时,生成氮气ymol,根据N2(g)+3H2(g)
 2NH3(g);△H=-92.4kJ/mol,可知吸收的热量为ymol×92.4kJ/mol=92.4ykJ,即b=92.4y.所以a+b=92.4(1-y)+92.4y=92.4,故答案为:a+b=92.4;
2NH3(g);△H=-92.4kJ/mol,可知吸收的热量为ymol×92.4kJ/mol=92.4ykJ,即b=92.4y.所以a+b=92.4(1-y)+92.4y=92.4,故答案为:a+b=92.4; (4)A.升高温度,平衡向吸热方向移动,即向逆反应,c(NH3)减小,故A错误;
B.向容器充入1molAr(g),体积增大,等效为减小压强,平衡向逆反应移动,c(NH3)减小,故B错误;
C.向容器中充入2molNH3,与原平衡等效,c(NH3)不变,故C正确;
D.选用效果更好的催化剂,平衡状态不移动,c(NH3)不变,故D正确.
故选:CD.
点评:本题主要考查化学平衡计算,难度较大,注意等效平衡的利用是解题的关键.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
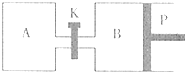 (2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下: 图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计).在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)
图中,P为可自由滑动的活塞,关闭K,V(A)=aL,V(B)=0.8aL(连通管的体积忽略不计).在相同温度和有催化剂存在的条件下,分别向容器A、B中各充入1molN2和3molH2,发生反应N2(g)+3H2(g)  2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL.
2NH3(g);△H=-92.4kJ/mol.达到平衡后,V(B)=0.6aL. 2C(g);△H=
-a kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
2C(g);△H=
-a kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题: