题目内容
已知实验室制氢气的反应:Zn+2HCl= ZnCl2+H2↑。现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余.
(1)用双线桥或单线桥标出电子转移的方向和数目
(2)比较H+和Zn2+氧化性强弱
(3)消耗盐酸的体积至少为 多少升?
多少升?
(4)生成ZnCl2的物质的量为多少?
(5)标准状况下,最多能收集到多少升气体?
(6)反应中转移的电子的个数
成分 | 质量(g) | 摩尔质量(g•mol﹣1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是 .
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银
(2)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、 、 .(在横线上填写所缺仪器的名称)需要高锰酸钾 mol
(3)在溶液配制过程中,下列操作对配制结果没有影响的是 .
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol/L.
常温下,根据表中的几种物质的电离平衡常数回答下列问题:
NH3·H2O | 2×10-5 |
HNO2 | 7×10-4 |
HClO | 3×10-8 |
H2CO3 | K1=4×10-7 K2=4×10-11 |
(1)常温下,等浓度的NH4 NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH
NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH )较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO
)较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO 水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH 7 (填“>”、“<”或“=”);反应NH3·H2O+H2CO3 NH
NH +HCO
+HCO +H2O的平衡常数K= 。
+H2O的平衡常数K= 。
(3) 少量CO2通入到过量的NaClO溶液中发生反应的离子方程式  :
:



 过滤装置 B.步骤(2)需要用到分液漏斗
过滤装置 B.步骤(2)需要用到分液漏斗
 n-+3Cl- +5H2O。则RO4n-中 r 的化合价是
n-+3Cl- +5H2O。则RO4n-中 r 的化合价是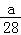 mol-1 B.amol-1 C.28amol-1 D.
mol-1 B.amol-1 C.28amol-1 D.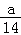 mol-1
mol-1