题目内容
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
B
考查可逆反应的有关计算。根据E的反应速率可知,生成E的物质的量是0.1 mol·L-1·min-1×0.4L×5min=0.2mol,所以计量数m=1。则
2A(g)+B(g) D(g)+E(g)
D(g)+E(g)
起始量(mol) 0.6 0.5 0 0
转化量(mol) 0.4 0.2 0.2 0.2
平衡量(mol) 0.2 0.3 0.2 0.2
所以A和B的转化率分别为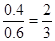 、
、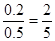 ,因此选项A不正确。
,因此选项A不正确。
因为速率之比是相应的化学计量数之比
所以5min内用A表示的平均反应速率为0.1 mol·L-1·min-1×2=0.2 mol·L-1·min-1
平衡时混合物总物质的量为0.2mol+0.3mol+0.2mol+0.2mol=0.9mol
所以答案选B。
2A(g)+B(g)
 D(g)+E(g)
D(g)+E(g)起始量(mol) 0.6 0.5 0 0
转化量(mol) 0.4 0.2 0.2 0.2
平衡量(mol) 0.2 0.3 0.2 0.2
所以A和B的转化率分别为
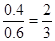 、
、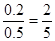 ,因此选项A不正确。
,因此选项A不正确。因为速率之比是相应的化学计量数之比
所以5min内用A表示的平均反应速率为0.1 mol·L-1·min-1×2=0.2 mol·L-1·min-1
平衡时混合物总物质的量为0.2mol+0.3mol+0.2mol+0.2mol=0.9mol
所以答案选B。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
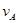 、
、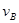 、
、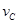 表示,已知2
表示,已知2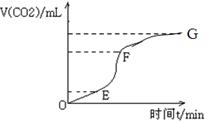
 2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是 ( )
2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是 ( ) xC(g)+D(g),经4min后,测得D的浓度为
xC(g)+D(g),经4min后,测得D的浓度为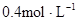 ,A、B物质的量浓度之比为5:1,C的平均反应速率是
,A、B物质的量浓度之比为5:1,C的平均反应速率是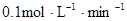 。
。 2SO3
2SO3