题目内容
将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是( )
| A.Fe3+和Cu2+ | B.Fe2+和Cu2+ | C.Fe2+ | D.Fe2+和Fe3+ |
C
铜片和铁片表面的CuO和Fe2O3,加入足量的稀盐酸,先发生如下两个反应:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生反应:2Fe3++Fe=3Fe2+,若Fe3+过量,则接着发生反应2Fe3++Cu=2Fe2++Cu2+,若Fe过量,则还会发生反应Fe+Cu2+=Fe2++Cu,但不论哪种情况溶液中都有Fe2+存在

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
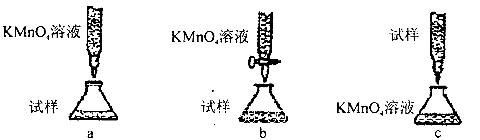
 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。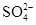 生成,可向溶液中滴加Ba(NO3)2溶液
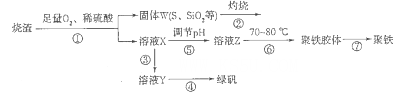
生成,可向溶液中滴加Ba(NO3)2溶液 xH2O)。有如下操作:
xH2O)。有如下操作: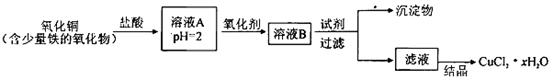
 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

 溶液18.00mL。该样品中
溶液18.00mL。该样品中