题目内容
【题目】在下列各元素组中,除一种元素外,其余都可以按照某种共性归属为一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表中。
其他元素可能归属类型:①主族元素;②过渡元素;③同周期元素;④同主族元素;⑤金属元素;⑥非金属元素。_____________、___________________、_____________、___________________、_____________、___________________、_____________、___________________
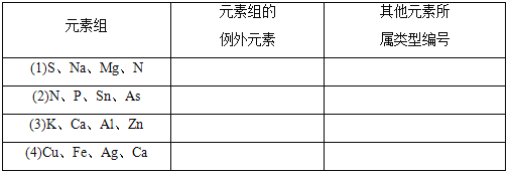
【答案】 N ③ Sn ④ Zn ① Ca ②
【解析】(1)中Na、Mg、S为第三周期元素,N为第二周期元素,答案:N ③
(2)中N、P、As为ⅤA族元素,Sn为ⅤIA族元素,答案:.Sn ④
(3)中K、Ca、Al是主族元素,Zn为副族元素,答案: Zn ①
(4)中Cu、Fe、Ag是过渡元素。Ca 主族元素,答案 :. Ca ②

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
【题目】用如图所示装置检验乙烯时不需要除杂的是( ) 
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | Br2的CCl4溶液 |
A.A
B.B
C.C
D.D