题目内容
【题目】在稀硫酸和稀硝酸的混合溶液中,加入铜粉。
(1)若将50mL 4mol/L 稀HNO3和200mL 0.5mol/L稀H2SO4混合后,加入19.2g 铜粉,微热,充分反应。
①若忽略溶液体积变化,溶液中铜离子物质的量浓度为________mol/L。
②若使铜粉全部溶解,还需加入0.5mol/L H2SO4________________________mL。
(2)若c(SO42—)+c(NO3—)=a mol·L-1。取200 mL该混合酸,则能溶解铜的最大物质的量为___________mol(用含a的式子表示)。
【答案】 0.6 400 0.12a
【解析】(1)50mL 4mol/L 稀HNO3和200mL 0.5mol/L稀H2SO4混合后,溶液中n(NO3-)=50![]() 10-3L
10-3L![]() 4mol/L=0.2mol,n(SO42-)=200
4mol/L=0.2mol,n(SO42-)=200![]() 10-3L
10-3L![]() 0.5mol/L=0.1mol,n(H+)=0.2mol+0.1mol
0.5mol/L=0.1mol,n(H+)=0.2mol+0.1mol![]() 2=0.4mol,加入19.2g 铜粉的物质的量为0.3mol,微热,发生的反应为3Cu+2NO3-+8H+=3Cu2++NO↑+4H2O。因为n(Cu): n(NO3-): n(H+)=0.3:0.2:0.4=3:2:4,不等于化学计量数之比3:2:8,可以判断铜和硝酸根都过量,应按n(H+)计算,所以: ①若忽略溶液体积变化,溶液中铜离子物质的量浓度为
2=0.4mol,加入19.2g 铜粉的物质的量为0.3mol,微热,发生的反应为3Cu+2NO3-+8H+=3Cu2++NO↑+4H2O。因为n(Cu): n(NO3-): n(H+)=0.3:0.2:0.4=3:2:4,不等于化学计量数之比3:2:8,可以判断铜和硝酸根都过量,应按n(H+)计算,所以: ①若忽略溶液体积变化,溶液中铜离子物质的量浓度为  = 0.6mol/L。
= 0.6mol/L。
②若使铜粉全部溶解,由上面数据分析可知,还需要加入H+0.4mol,所以还需加入0.5mol/L H2SO4 ,  =0.4L=400mL。
=0.4L=400mL。
(2)若c(SO42—)+c(NO3—)=a mol·L-1。取200 mL该混合酸,n(SO42—)+n(NO3—)=0.2a mol,n(H+)= 2n(SO42—)+n(NO3—),由反应的离子方程式可知,当n(H+): n(NO3—)=8:2=4:1时,溶解的铜最多,联立上面三个式子可求出n(NO3—)=0.08amol,所以能溶解铜的最大物质的量为![]() 0.08a mol=0.12a mol。
0.08a mol=0.12a mol。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数如下表:
MnO2 时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
10 mL 1.5% | 223 s | 67 s | 56 s |
10 mL 3.0% | 308 s | 109 s | 98 s |
10 mL 4.5% | 395 s | 149 s | 116 s |
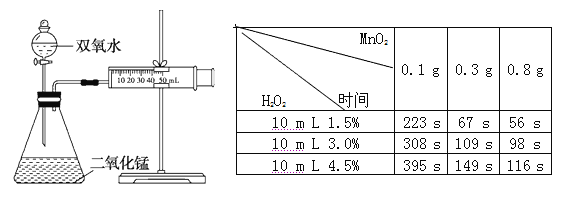
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性: 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而_______(填“加快”或“减慢”或“不变”)。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g(填“ 0.1 g”或“ 0.3 g”或“ 0.8 g”) 的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确___________(填“正确”或“ 不正确”),理由是___________________________。(提示:H2O2的密度可认为近似相等)。