题目内容
【题目】下列有关电解质溶液的说法正确的是
A. 0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c (Na+)>c(CO32-)>c(HCO3-)>c(OH-) >c(H+)
C. 常温下,pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
D. 将CH3COONa溶液从20℃升温至30℃,溶液中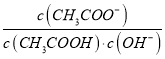 增大
增大
【答案】C
【解析】A、依据硫化钠溶液中存在的质子守恒分析,溶液中水电离出的氢氧根离子和氢离子相同,c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;B、0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,生成碳酸钠溶液,所以离子浓度大小为:C(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B错误;C、在相同的条件下测得①CH3COONa ②NaHCO3 ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,所以钠离子的浓度为:①>②>③,故C正确;D、CH3COONa溶液中Kh=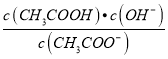 ,升高温度促进水解,Kh增大,则
,升高温度促进水解,Kh增大,则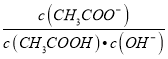 减小,故D错误;故选C。
减小,故D错误;故选C。

【题目】在298K时,已知下列物质的溶度积
CH3COOAg | AgCl | Ag2CrO4 | Ag2S | |
Ksp | 2.3×10-3 | 1.8×10-10 | 1.12×10-12 | 6.3×10-50 |
下列说法正确的是
A. 等体积浓度均为0.02 mol/L的CH3COONa和AgNO3溶液混合能产生沉淀
B. 向浓度均为0.01 mol/L的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C. 在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:
CH3COOAg+H++C1-= CH3COOH+AgCl
D. 上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)