题目内容
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为
A.(b-a)/V mol·L-1 B.2(2b-a)/V mol·L-1
C.2(b-a)/V mol·L-1 D.(2b-a)/V mol·L-1
【答案】B
【解析】
试题分析:一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,则该份溶液中Mg2+浓度为0.5a mol;另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则该份溶液中SO42-浓度为b mol;根据溶液中正负电荷之和为0,可设,一份溶液中钾离子的物质的量为n,则:![]() ,n=2b-a;则钾离子的物质的量浓度为:
,n=2b-a;则钾离子的物质的量浓度为: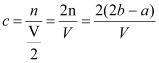 ,故答案B。
,故答案B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】化学与社会、生活密切相关,对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 小苏打用作焙制糕点的膨松剂 | Na2CO3溶液呈碱性 |
B | 明矾可用于净水 | 明矾在水中生成的氢氧化铝胶体有吸附性 |
C | SiO2用于制造光导纤维 | SiO2有导电性 |
D | SO2可使溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D