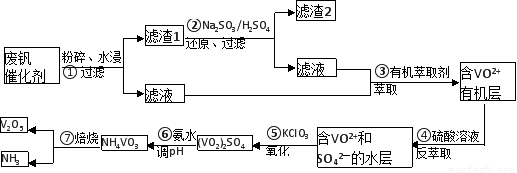
题目内容

根据题目要求,回答下列问题:
(1)写出H2C2O4?2H2O在浓硫酸催化作用下制备CO的化学方程式.
| ||
| △ |
| ||
| △ |
(2)用a~h表示连接顺序,正确顺序为a
(3)用A~F正确表示下面实验操作的先后顺序:
A.点燃甲装置的酒精灯,打开分液漏斗,调节浓硫酸的滴速.
B.点燃乙装置中的酒精灯,加热氧化铁.
C.检查整套装置的气密性.
D.将导管口i处的尾气验纯后,点燃加以处理.
E.待乙装置玻璃管内的Fe2O3完全变黑时,熄灭乙装置中的酒精灯.
F.关好甲装置中分液漏斗的开关后,再熄灭该装置中的酒精灯.
(4)空洗气瓶的作用是
(5)假设H2C2O4?2H2O的分解产物以气体形式从a处导出,则该混合气体的平均摩尔质量为
(6)假设乙中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取a克混合物充分反应后,质量减轻了
| 8a |
| 29 |
(2)根据原理和各装置的作用连接,得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO;
(4)除去二氧化碳要防止溶液倒吸;进入乙装置的气体应干燥;
(5)根据质量守恒,混合气体的质量等于草酸晶体的质量,结合方程式可知,混合气体的物质的量为草酸晶体的5倍,由摩尔质量定义可得,混合气体的平均摩尔质量为草酸晶体的1/5;
(6)质量减轻
| 8a |
| 29 |
H2C2O4?2H2O
| 浓硫酸 |
| △ |
故答案为:H2C2O4?2H2O
| ||
| △ |
(2)得到纯净干燥的一氧化碳应先除去二氧化碳后干燥,除去二氧化碳要防止溶液倒吸,所以装置的连接顺序为a接d;e 接g;f 接c; b 接h,
故答案为:d e g f c b h;
(3)制备气体要先检验装置的气密性,然后加料制备CO并用CO排尽装置难度空气,CO有毒,污染空气,验纯后,点燃处理,再进行用CO炼铁实验,使用结束,为防止铁被氧化,冷却后,停止通CO.所以操作步骤顺序为CADBEF,故答案为:CADBEF;
(4)除去二氧化碳要防止溶液倒吸,进入乙装置的气体应干燥,所以空洗气瓶的作用是防倒吸,浓硫酸洗气瓶的作用是干燥CO,
故答案为:防倒吸;干燥CO;
(5)混合气体的质量等于草酸晶体的质量,混合气体的物质的量为草酸晶体的5倍,由摩尔质量定义可得,混合气体的平均摩尔质量为草酸晶体的1/5,混合气体的摩尔质量为126g/mol×
| 1 |
| 5 |
(6)a克铁氧化物的混合物所含铁原子的质量为(a-
| 8a |
| 29 |
| 21a |
| 29 |
所以混合物中n(Fe):n(O)=
| ||
| 56g/mol |
| ||
| 16g/mol |
由于Fe3O4中铁原子与氧原子的个数比为3:4,只要FeO与Fe2O3保证混合铁原子与氧原子的个数比为3:4,即可,与Fe3O4任意含量无关,
令n(FeO)为x,n(Fe2O3)为y,所以有(x+2y):(x+3y)=3:4,即x:y=1:1,
且满足三者质量之和为ag,即72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a
故答案为:n(FeO):n(Fe2O3)=1:1,n(Fe3O4)≥0;72n(FeO)+160n(Fe2O3)+232n(Fe3O4)=a

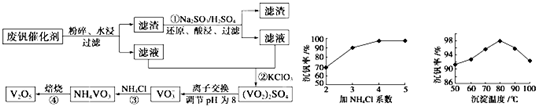
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为
(2)滤液中含钒的主要成分为
(3)该工艺中反应①的化学方程式为
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为2VO
+ 2 |
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g·cm—3 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
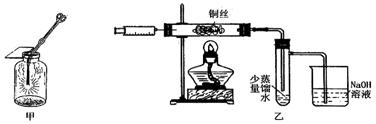
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。

(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
|
分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
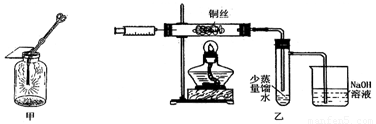
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。

 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。