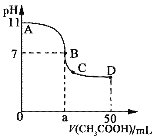
题目内容
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
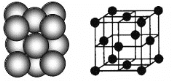
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
【答案】(1)第四周期ⅠB族(1分) 1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(1分)
(2)①N>O>C(1分)
②ACE(2分)
③sp2(2分) 平面正三角形(2分) O3(2分)
(3)12(2分) 74%(2分)
【解析】(1)铜元素在周期表中的位置是第四周期ⅠB族。基态铜原子的电子排布式是1s22s22p63s23p63d104s1或写成[Ar]3d104s1。
(2)①同周期元素的第一电离能总体上随着原子序数的增大而增大,但是N的最外层电子排布是2s22p3,p轨道半充满较稳定,因此第一电离能比O大,所以C、N、O三种元素的第一电离能从大到小的顺序为N>O>C。②Ag+和NH3间是配位键,[Ag(NH3)2]+和OH间是离子键,NH3内部是极性键。故选ACE。③![]() 的孤电子对数为0,价电子对数为3,成键电子对数为3,故空间构型为平面正三角形,中心原子杂化轨道类型为sp2。与
的孤电子对数为0,价电子对数为3,成键电子对数为3,故空间构型为平面正三角形,中心原子杂化轨道类型为sp2。与![]() 、SO2互为等电子体的短周期元素单质分子是O3。
、SO2互为等电子体的短周期元素单质分子是O3。
(3)面心立方最密堆积的配位数为12。设银原子的直径为d,每个银晶胞含4个银原子,则:空间利用率= ×100%=74%。
×100%=74%。