题目内容
【题目】乳酸亚铁晶体{CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,广泛应用于乳制品、营养液等,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑
Ⅰ.制备碳酸亚铁(FeCO3):装置如图所示。
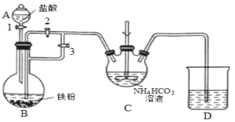
(1)仪器C的名称是______。
(2)清洗仪器,检查装置气密性,A中加入 盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞_____,打开活塞_____,装置B中可观察到的现象是_____,当加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞_____,打开活塞_____。C中发生的反应的离子方程式为_____。
Ⅱ. 制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是_____。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,冷却结晶、过滤、洗涤、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.76g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00 mL,用0.100mol/LCe(SO4)2标准溶液滴定至终点,记录数据如表所示。
滴定次数 | 0.100mol/LCe(SO4)2标准溶液/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.65 |
2 | 0.12 | 22.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为______(以质量分数表示,保留3位有效数字)。
【答案】三颈烧瓶 2 1、3 铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色 3 2 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 防止FeCO3与乳酸反应产生的亚铁离子被氧化 乳酸根中羟基被酸性高锰酸钾溶液氧化 98.0%
【解析】
亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,利用生成的氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,据此解答本题。
(1)仪器C为三颈烧瓶,
故答案为:三颈烧瓶;
(2)反应前先利用生成的氢气除去装置内空气,再利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞2,打开活塞3,然后打开活塞1加入足量的盐酸,然后关闭活塞1,反应一段时间后,装置B中可观察到的现象为:铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色;打开活塞2,关闭活塞3;C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:2;1、3;铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色;3;2;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,可防止Fe2+离子被氧化,
故答案为:防止FeCO3与乳酸反应产生的亚铁离子被氧化;
(4)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%,
故答案为:乳酸根中羟基被酸性高锰酸钾溶液氧化;
(5)三次滴定第二次操作消耗标准液数值明显偏大,应舍去,取第一次和第三次平均值V=![]() =19.60mL,由:Ce4++Fe2+=Ce3++Fe3+,可知25mL溶液中n(Fe2+)=n(Ce4+)=0.100mol/L×0.0196L=0.00196mol,故250mL含有n(Fe2+)=0.00196mol×
=19.60mL,由:Ce4++Fe2+=Ce3++Fe3+,可知25mL溶液中n(Fe2+)=n(Ce4+)=0.100mol/L×0.0196L=0.00196mol,故250mL含有n(Fe2+)=0.00196mol×![]() =0.0196mol,故产品中乳酸亚铁晶体的质量分数为
=0.0196mol,故产品中乳酸亚铁晶体的质量分数为![]() =98.0%,
=98.0%,
故答案为:98.0%。

 阅读快车系列答案
阅读快车系列答案【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
