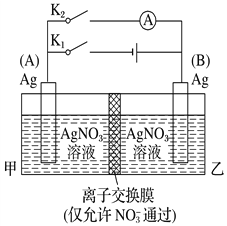
题目内容
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
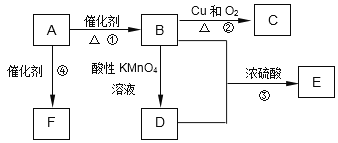
(1)A的结构式为__________,B分子中的官能团名称是___________。
(2)E的名称为________________,写出与D含有相同官能团的E的一种同分异构体的结构简式________________________________________(任写一种)。
(3)写出下列反应④的化学方程式并指出反应类型:
__________________________________________;反应类型是_____________;
(4)某学习小组做以下实验:在溴水中加入足量 C 溶液,充分反应,溴水褪色。为探究褪色的原因,他们提出了如下三种猜想:
① 溴水中的Br2可能与 C 发生了取代反应
② C 分子中可能含有不饱和键,溴水可能与 C 发生了加成反应
③ C 具有还原性,溴水可能将 C 氧化为酸,Br2转化为HBr
为探究哪一种猜想正确,研究小组提出了如下两种方案:
方案(一):检验褪色后溶液的酸碱性,确定其发生哪类反应。
方案(二):测定反应前溴水中Br2的物质的量和反应后 Br﹣的物质的量,确定其发生哪类反应。
① 方案(一)是否可行?______(填“可行”或“不可行”)
② 假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br﹣)=____mol,则说明溴水与 C 发生了取代反应;若测得反应后n(Br﹣)=______mol,则说明溴水与乙醛发生了加成反应;
③ 向含Br2 0.01mol的溴水中加入足量C使其褪色,然后加过量的AgNO3溶液,过滤、洗涤、干燥、称量,得到固体3.76克。已知CH3COOAg易溶于水,通过计算,写出溴水与 C 发生反应的化学方程式为___________________________________。
【答案】 ![]() 羟基 乙酸乙酯 CH3CH2CH2COOH n CH2=CH2
羟基 乙酸乙酯 CH3CH2CH2COOH n CH2=CH2![]()
![]() 加聚反应 不可行 a 0 【答题空10】CH3CHO+Br2+H2O→CH3COOH+2HBr
加聚反应 不可行 a 0 【答题空10】CH3CHO+Br2+H2O→CH3COOH+2HBr
【解析】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,则A为乙烯,A发生加聚反应生成高聚物F为聚乙烯,B与D可以得到E,E是具有果香味的有机物,E为酯,故B为乙醇,反应①是乙烯与是发生加成反应生成乙醇,乙醇发生催化氧化生成C为乙醛,乙醇被酸性高锰酸钾氧化生成D为乙酸,乙酸与乙醇发生酯化反应生成E为乙酸乙酯。
(1)乙烯的结构式为![]() ,乙醇分子中的官能团为羟基,故答案为:
,乙醇分子中的官能团为羟基,故答案为:![]() ;羟基;
;羟基;
(2)E为乙酸乙酯,D为乙酸,与D含有相同官能团的E的一种同分异构体为CH3CH2CH2COOH或CH(CH3)2COOH,故答案为:乙酸乙酯;CH3CH2CH2COOH或CH(CH3)2COOH;
(3)反应④为乙烯的加聚反应,反应的化学方程式为n CH2=CH2 ![]()
![]() ,故答案为:n CH2=CH2
,故答案为:n CH2=CH2 ![]()
![]() ;加聚反应;
;加聚反应;
(4)①溴水与乙醛发生取代反应有HBr生成;乙醛被氧化生成乙酸和HBr,溶液均呈酸性,所以无法检验褪色后溶液的酸碱性,确定其发生哪类反应;故答案为:不可行;
②若发生取代反应,1molBr2可生成1molHBr,故反应后n(Br-)=amol;若发生加成反应,则无HBr生成,故反应后n(Br-)=0,故答案为:a;0;
③得到固体3.76g为AgBr的质量,n(AgBr)= ![]() =0.02mol,n(Br-)=2n(Br2),则反应为氧化反应,反应方程式为:CH3CHO+Br2+H2O→CH3COOH+2HBr;故答案为:CH3CHO+Br2+H2O→CH3COOH+2HBr。
=0.02mol,n(Br-)=2n(Br2),则反应为氧化反应,反应方程式为:CH3CHO+Br2+H2O→CH3COOH+2HBr;故答案为:CH3CHO+Br2+H2O→CH3COOH+2HBr。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】COS 、H2S是许多煤化工产品的原料气。已知
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=X kJ·mol-1;
H2S(g)+CO(g) △H=X kJ·mol-1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1;
(1)断裂1 mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1319 | 442 | 1076 | 678 | 930 | 1606 |
X=___________。
(2)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应,在T10C时达到平衡,体系内CO的体积分数为5%(如下图M点)。

请回答下列问题:
①请在图中画出以M为起点,从T1℃开始升温过程中CO的平衡体积分数随温度变化的曲线。_____
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol,则平衡时H2O的转化率为_________。
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M中充入1 mol CO和1 mol H2O,在N中充入1 mol CO2和1 mol H2,均在700 ℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_______。
A.容器M、N中正反应速率相同
B.容器M中CO的物质的量比容器N中的多
C.容器M、N中反应的平衡常数相同
D.容器M中CO的转化率与容器N中CO2的转化率之和小于1
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
______________________________________;常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL(标况)H2S气体,反应后离子浓度从大到小顺序为_____________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示:

①25℃时Ksp(CuS)=__________________。
②25℃时向50.0mL Sn2+、Cu2+浓度均为0.01mol·L-1的混合溶液中逐滴加入Na2S溶液到50.0mL时开始生成SnS沉淀,此时溶液中Cu2+浓度为__________mol/L。