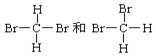题目内容
【题目】低碳经济成为人们一种新的生活理念。二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合所学知识回答:
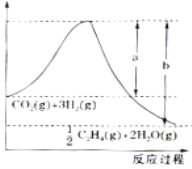
(1)①用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
已知:几种化学键的键能如下表所示,实验测得上述反应的△H=-152kJmol﹣1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | H-O |
键能/kJmol﹣1 | 803 | 436 | x | 414 | 464 |
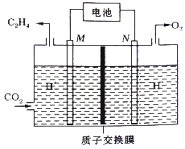
② 以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如下图所示。则N极上的电极反应式为____________;该电解池中所发生的总反应的化学方程式为__________。
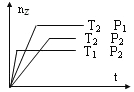
(2)用CO2催化加氢可以制取乙醚的反应如下:2CO2(g)+6H2(g)![]() CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
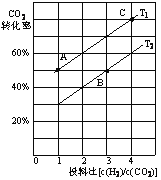
①T1_______T2(填“<”、“=”或“>”),判断理由是__________________________。
②T1温度下,将6 mol CO2和12mol H2充入2 L的密闭容器中,经过5 min反应达到平衡,则0~ 5 min内的平均反应速率υ(CH3OCH3)=______。
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是______(填标号)。
A.逆反应速率先增大后减小 B.容器中 c(H2)/c(CO2)的比值减小
C.H2的转化率增大
【答案】 -(b-a)kJmol﹣1 764 kJmol﹣1 2H2O-4e-═4H++O2↑ 2CO2+2H2O![]() C2H4+3O2↑ < 因为反应放热,相同配比投料时, T1温度下转化率大于T2温度下的转化率,平衡逆向移动,可知T1<T2 0.18 molL﹣1min﹣1 C
C2H4+3O2↑ < 因为反应放热,相同配比投料时, T1温度下转化率大于T2温度下的转化率,平衡逆向移动,可知T1<T2 0.18 molL﹣1min﹣1 C
【解析】试题分析:本题考查反应热的计算,电解原理的应用和电极反应式、电解方程式的书写,化学平衡图像的分析,化学反应速率的计算以及外界条件对化学平衡的影响。
(1)①由图知CO2(g)+3molH2(g)具有的总能量大于1/2C2H4(g)+2H2O(g)具有的总能量,该反应为放热反应,反应的ΔH=生成物具有的总能量-反应物具有的总能量=-(b-a)kJ/mol。ΔH=反应物的键能总和-生成物的键能总和=2E(C=O)+3E(H-H)-[1/2E(C=C)+2E(C-H)+4E(H-O)]=2![]() 803kJ/mol+3
803kJ/mol+3![]() 436kJ/mol-[1/2x+2
436kJ/mol-[1/2x+2![]() 414kJ/mol+4
414kJ/mol+4![]() 464kJ/mol]=-152kJ/mol,解得x=764kJ/mol。
464kJ/mol]=-152kJ/mol,解得x=764kJ/mol。
②根据图示,在M电极上CO2发生得电子的还原反应生成C2H4,M电极为阴极,M极上的电极反应式为2CO2+12e-+12H+=C2H4+4H2O;N电极为阳极,N电极上生成O2, N极上的电极反应式为2H2O-4e-=O2↑+4H+。则电解池中所发生的总反应的化学方程式为2CO2+2H2O![]() C2H4+3O2。
C2H4+3O2。
(2)①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,CO2的转化率减小,根据图像知在投料比相同时,T1平衡时CO2的转化率大于T2,则T1![]() T2。
T2。
②H2与CO2的投料比为12mol![]() 6mol=2,根据图像投料比为2时,T1温度下CO2的平衡转化率为60%。转化CO2物质的量浓度为
6mol=2,根据图像投料比为2时,T1温度下CO2的平衡转化率为60%。转化CO2物质的量浓度为![]() 60%=1.8mol/L,则转化CH3OCH3(g)物质的量浓度为0.9mol/L,0~5min内平均反应速率υ(CH3OCH3)=0.9mol/L
60%=1.8mol/L,则转化CH3OCH3(g)物质的量浓度为0.9mol/L,0~5min内平均反应速率υ(CH3OCH3)=0.9mol/L![]() 5min=0.18mol/(L·min)。
5min=0.18mol/(L·min)。
③A,逆反应速率先增大后减小,平衡一定向逆反应方向移动;B,容器中c(H2)/c(CO2)的比值减小,可能增大CO2浓度、减小H2浓度,增大CO2浓度平衡向正反应方向移动,减小H2浓度平衡向逆反应方向移动;C,H2的转化率增大,平衡一定向正反应方向移动;改变某个条件,平衡一定向正反应方向移动的是C,答案选C。