题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
【答案】Na>N>O HNO3>H2CO3>H2SiO3  2Al+2OH-+2OH-=2
2Al+2OH-+2OH-=2![]() +3H2↑ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1
+3H2↑ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1
【解析】
根据元素周期表,推出①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,据此分析;
(1)③为N,④为O,⑤为Na,同周期从左向右原子半径依次减小,同主族从上到下,原子半径依次增大,因此原子半径由大到小的顺序是Na>N>O;
(2)②为C,③为N,⑦为Si,非金属性越强,其最高价氧化物对应水化物的酸性越强,同主族从上到下,非金属性减弱,同周期从左向右非金属性增强,因此最高价氧化物对应的水化物的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3;
(3)②为C,⑧为Cl,两种元素形成的某化合物是一种常见的有机溶剂,即为CCl4,CCl4属于共价化合物,其电子式为 ;
;
(4)⑥为Al,与NaOH溶液反应的离子方程式为2Al+2OH-+2OH-=2![]() +3H2↑;
+3H2↑;
(5)⑦为Si,其最简单的氢化物为SiH4,与氧气反应的方程式为SiH4+2O2=SiO2+2H2O,1gSiH4的物质的量为![]() =
=![]() mol,1molSiH4燃烧放出的热量为45.0kJ×32=1440.0kJ,则热化学反应方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1。
mol,1molSiH4燃烧放出的热量为45.0kJ×32=1440.0kJ,则热化学反应方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1。

【题目】已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
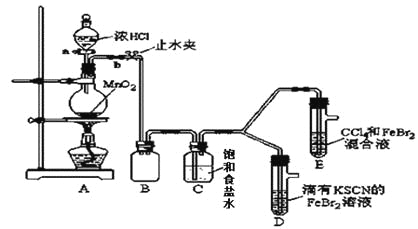
(1)①装置A中发生反应的离子方程式是_________________。
②整套实验装置存在一处明显的不足,请指出________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后_______________。(填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后______。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因____。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加________溶液,若溶液颜色______________。则上述解释是合理的。
小组同学另查得资料如下:
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因___________、___________。





