题目内容
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为__、__,制得等量H2所需能量较少的是__。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=__%,反应平衡常数K=__。
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2__α1,该反应的ΔH__0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__(填标号)
A.H2S B.CO2 C.COS D.N2
【答案】H2O(l)=H2(g)+![]() O2(g) ΔH=+286kJ·mol-1 H2S(g)=H2(g)+S(s) ΔH=+20kJ·mol-1 系统(II) 2.5 2.8×10-3 > > B
O2(g) ΔH=+286kJ·mol-1 H2S(g)=H2(g)+S(s) ΔH=+20kJ·mol-1 系统(II) 2.5 2.8×10-3 > > B
【解析】
(1)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统(I)的热化学方程式H2O(l)=H2(g)+![]() O2(g) ΔH=+286kJ·mol-1;
O2(g) ΔH=+286kJ·mol-1;
系统(II)的热化学方程式H2S (g)=H2(g)+S(s)△H=+20kJ·mol-1。
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II。
故答案为:H2O(l)=H2(g)+![]() O2(g) ΔH=+286kJ·mol-1;H2S (g)=H2(g)+S(s)△H=+20kJ·mol-1;系统(Ⅱ);
O2(g) ΔH=+286kJ·mol-1;H2S (g)=H2(g)+S(s)△H=+20kJ·mol-1;系统(Ⅱ);
(2)列出反应的三段式:
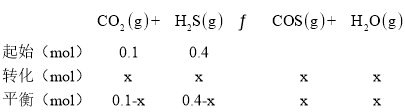
反应平衡后水的物质的量分数为0.02,![]() x=0.01;
x=0.01;
①H2S的平衡转化率a1=![]() ×100%=2.5%,
×100%=2.5%,
体积为2.5L,则平衡时各物质的浓度为c(H2S)=![]() =0.156mol·L-1,c(CO2)=
=0.156mol·L-1,c(CO2)=![]() =0.036mol·L-1,c(COS)=c(H2O)=
=0.036mol·L-1,c(COS)=c(H2O)=![]() =0.004mol·L-1,则K=
=0.004mol·L-1,则K=![]() =2.8×10-3;
=2.8×10-3;
故答案为:2.5%;2.8×10-3;
②610K升高到620K重复试验,平衡后水的物质的量分数为0.03,升高温度平衡正向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,正方向为吸热反应,H2S的转化率α2>α1,该反应的ΔH>0。
故答案为:>;>;
③A.通入H2S ,H2S转化率降低,故A不选;
B.通入CO2,H2S转化率增大,故B选;
C.通入COS,平衡逆向移动,故C不选;
D.通入N2,平衡不移动,故D不选;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。