题目内容
下列判断正确的是 ( )
①Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质;②强电解质溶液的导电能力可能比弱电解质导电能力弱;③液态氯化氢不导电,但它是电解质;④碳酸氢钠是弱酸的酸式盐,所以是弱电解质;⑤SO3溶于水后导电,所以SO3是电解质;⑥Cu能导电,但它不是化合物,所以Cu是非电解质
| A.②③ | B.②③⑥ | C.①④⑤⑥ | D.②③⑤ |
A
解析试题分析:①溶解性与电解质的强弱没有关系,错误;②如果强电解质溶液浓度很小,弱电解质溶浓度很大,也有可能强电解质溶液的导电能力可能比弱电解质导电能力弱;③HCl溶于水所得溶液可以导电,是电解质,正确;④弱酸的酸式盐也是强电解质,错误;⑤SO3溶于水,与水反应:SO3+H2O=H2SO4,H2SO4是电解质,SO3为非电解质,错误;⑥非电解质属于化合物,所以Cu不是非电解质,错误。
考点:本题考查电解质、非电解质、强电解质、弱电解质的概念。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列各组离子中,一定能在指定溶液中大量共存的是:
| A.澄清透明的无色溶液:ClO-、CrO42-、Al3+、SO42- |
| B.能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- |
| C.常温呈中性的溶液中:Fe3+、K+、Cl-、SO42- |
| D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A.等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合:3Ba2++6OH -+2Al3++3SO42- ="==" 2Al(OH)3↓+3BaSO4↓ |
| B.FeSO4酸性溶液暴露在空气中:4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH - |
| C.向AlCl3 溶液中投入过量Na:2Al 3+ + 6Na + 6H2O = 2Al(OH)3 ↓ + 6Na+ + 3H2↑ |
| D.向FeBr2溶液中通入少量Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl- |
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
| A.由水电离的c(H+)=10-4mol/L的溶液中:Fe2+、SO42—、K+、NO3— |
| B.由水电离的c(H+)=10-14mol/L的溶液中:Ca2+、Na+、HCO3—、NO3— |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、SO42—、Cl— |
| D.c(Fe3+)=0.1mol/L的溶液中:Na+、K+、NO3—、SO32— |
对下列离子组共存情况的判断正确的是 ( )
| A.使石蕊溶液变红的溶液中Fe2+、Cl-、NO3-、Na+能大量共存 |
| B.使酚酞溶液变红的溶液中Na+、AlO2-、NO3-、HCO3-能大量共存 |
| C.加入铝粉产生H2的溶液,可能存在大量的Na+、Ba2+、AlO2-、NO3- |
| D.含大量Fe3+的溶液中K+、NH4+、SO42-、SCN-能大量共存 |
下列离子方程式正确的是
| A.向Ca(OH)2溶液中通入过量CO2:Ca2++2OH—+CO2=CaCO3↓+H2O |
| B.将盐酸溶液滴加到石灰石中:CO32—+2H+=CO2↑+H2O |
| C.将少量H2SO4溶液滴加到Ba(OH)2溶液中:2H++SO42—+2OH—+Ba2+=BaSO4↓+2H2O |
| D.将铁粉加入到AgNO3溶液中:Fe+Ag+=Ag+Fe2+ |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、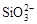 、
、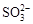 、
、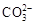 、
、 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验: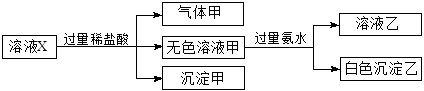
下列判断正确的是( )
| A.气体甲一定是纯净物 |
B.K+、[Al(OH)4]-和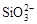 一定存在于溶液X中 一定存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
D.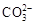 和 和 一定不存在于溶液X中 一定不存在于溶液X中 |
下列离子方程式书写正确的是( )
| A.氯化钡溶液中通入二氧化碳气体:Ba2++CO2+H2O=BaCO3↓+2H+ |
| B.次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO |
| C.醋酸和碳酸氢钠溶液混合:CH3COOH+HCO3-=CO2↑+H2O+CH3COO- |
| D.碳酸氢镁溶液中加入过量石灰水: |
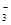 +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ 向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )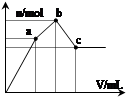
| A.a点的溶液呈中性 |
| B.b点到c点之间发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— =Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |