题目内容
【题目】研究表明不含结晶水的X(由4种短周期元素组成),可作为氧化剂和漂白剂,被广泛应用于蓄电池工业等。为探究X的组成和性质,设计并完成了下列实验:
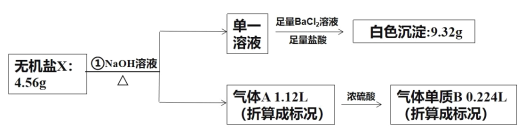
已知:气体单质B可使带火星的木条复燃。
(1)X中含有的元素为:____;图中被浓硫酸吸收的气体的电子式为:_____。
(2)请写出①的化学方程式:_____。
(3)已知X常用于检验Mn2+,它可将Mn2+氧化成MnO4-。请写出X溶液和少量MnCl2溶液反应的离子方程式:_____。
【答案】N、H、S、O ![]() 2(NH4)2S2O8+8NaOH=4Na2SO4+4NH3+O2↑+6H2O 7S2O82-+2Mn2++4Cl-+8H2O=2Cl2↑+2MnO4-+14SO42-+16H+
2(NH4)2S2O8+8NaOH=4Na2SO4+4NH3+O2↑+6H2O 7S2O82-+2Mn2++4Cl-+8H2O=2Cl2↑+2MnO4-+14SO42-+16H+
【解析】
从图中可以采集以下信息:m(X)=4.56g,m(BaSO4)=9.32g,V(O2)=0.224L,V(NH3)=1.12L-0.224L=0.896L。n(BaSO4)=![]() ,n(O2)=
,n(O2)=![]() ,n(NH3)=
,n(NH3)=![]() 。在X中,m(NH4+)=0.04mol×18g/mol=0.72g,m(S)=0.04mol×32g/mol=1.28g,则X中所含O的质量为m(O)= 4.56g-0.72g-1.28g=2.56g,n(O)=
。在X中,m(NH4+)=0.04mol×18g/mol=0.72g,m(S)=0.04mol×32g/mol=1.28g,则X中所含O的质量为m(O)= 4.56g-0.72g-1.28g=2.56g,n(O)=![]() 。
。
X中所含NH4+、S、O的个数比为0.04:0.04:0.16=1:1:4,从而得出X的最简式为NH4SO4,显然这不是X的化学式,X可作为氧化剂和漂白剂,则其分子中应含有过氧链,化学式应为(NH4)2S2O8。
(1)从以上分析,可确定X中含有的元素;图中被浓硫酸吸收的气体为NH3。
(2)反应①中,(NH4)2S2O8与NaOH反应,生成BaSO4、NH3、O2等。
(3)已知X常用于检验Mn2+,它可将Mn2+氧化成MnO4-。则(NH4)2S2O8与MnCl2反应生成MnO4-、Cl2、SO42-等。
(1)从以上分析,可确定X中含有的元素为N、H、S、O;图中被浓硫酸吸收的气体为NH3,电子式为![]() 。答案为:N、H、S、O;
。答案为:N、H、S、O;![]() ;
;
(2)反应①中,(NH4)2S2O8与NaOH反应,生成BaSO4、NH3、O2等,且三者的物质的量之比为4:4:1,化学方程式为2(NH4)2S2O8+8NaOH=4Na2SO4+4NH3+O2↑+6H2O。答案为:2(NH4)2S2O8+8NaOH=4Na2SO4+4NH3+O2↑+6H2O;
(3)已知X常用于检验Mn2+,它可将Mn2+氧化成MnO4-。则(NH4)2S2O8与MnCl2反应生成MnO4-、Cl2、SO42-等。S2O82-中有两个O从-1价降低到-2价,共得2e-;MnCl2中,Mn2+由+2价升高到+7价,Cl-由-1价升高到0价,MnCl2共失7e-,从而得到下列关系:7S2O82-+2Mn2++4Cl-——2Cl2↑+2MnO4-+14SO

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
Y | |||
M | X | Z |
A.钠与Z可能形成Na2Z2化合物
B.由X与氧组成的物质在熔融时能导电
C.Y的最简单气态氢化物的热稳定性比X的强
D.M的简单离子半径是同周期中简单离子半径最小的