题目内容
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l) +3 O2 (g) = 2CO2(g) +3H2O(l) △H=-1366.8 kJ/ mol
②2H2 (g) + O2 (g) = 2H2O(l) △H= -571.6 kJ/ mol
(1)写出由CO2 和H2 反应合成 CH3CH2OH (l) 和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。请写出该燃料电池负极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图:

该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
(1)2CO2 (g) + 6H2 (g) = CH3CH2OH(l) + 6H2O(l) △H= -348 kJ/ mol (2分)
(2)CH3CH2OH – 12e- + 16OH- == 2CO32- + 11H2O (2分)
(3)2NaCl + 2H2O 2NaOH
+ Cl2↑+ H2↑ (2分) 溶液变红
(1分) 13 (1分)
2NaOH
+ Cl2↑+ H2↑ (2分) 溶液变红
(1分) 13 (1分)
【解析】
试题分析:(1)首先写出CO2与H2反应的化学方程式并注明状态,然后根据盖斯定律求算反应热,∆H=-∆H1+3×∆H2=-348 kJ/ mol,可写出热化学方程式。
(2)在碱性条件下,CH3CH2OH失电子生成CO32‾、H2O,根据C元素升高的价数求出电子的系数为12,再原子守恒配平方程式,可得:CH3CH2OH – 12e- + 16OH- == 2CO32- + 11H2O。
(3)根据电解示意图可知左侧生成氢气,右侧生成氯气,则方程式为:2NaCl + 2H2O 2NaOH
+ Cl2↑+ H2↑;铁棒上水电离出的H+放电,使水的电离平衡向右移动,OH‾浓度增大,所以滴有酚酞的溶液变红;阴极产生448 mL气体,则生成0.02mol H2,根据化学方程式可得生成0.04mol NaOH,则c(NaOH)=0.04mol
÷0.4L=0.1mol•L‾1,可求出pH=13。
2NaOH
+ Cl2↑+ H2↑;铁棒上水电离出的H+放电,使水的电离平衡向右移动,OH‾浓度增大,所以滴有酚酞的溶液变红;阴极产生448 mL气体,则生成0.02mol H2,根据化学方程式可得生成0.04mol NaOH,则c(NaOH)=0.04mol
÷0.4L=0.1mol•L‾1,可求出pH=13。
考点:本题考查热化学方程式和电极方程式的书写、电解的原理。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案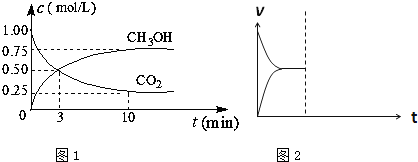
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol?L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从0min到10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.2CO2(g)+6H2(g)
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol?L-1、c(CO2)=0.05mol?L-1,此时反应向
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
 CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。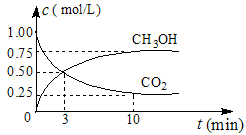
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g) 
 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。

 CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)

 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。