题目内容
已知Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的
倍,下列叙述中正确的是( )
| 3 |
| 5 |
分析:在混合溶液中存在c(Cl-)+2c(SO42-)=c(Na+),Cl-的物质的量浓度是Na+的物质的量浓度的
倍,设c(Na+)=5mol/L,则c(Cl-)=3moL/L,c(SO42-)=1mol/L,以此解答.
| 3 |
| 5 |
解答:解:在混合溶液中存在c(Cl-)+2c(SO42-)=c(Na+),Cl-的物质的量浓度是Na+的物质的量浓度的
倍,设c(Na+)=5mol/L,则c(Cl-)=3moL/L,c(SO42-)=1mol/L,
A.如c(Cl-)=3moL/L,则c(SO42-)=1mol/L,则Na2SO4 和NaCl的物质的量之比为1:3,故A正确;
B.溶液浓度和体积未知,不能确定物质的量大小关系,故B错误;
C.如c(Na+)=5mol/L,则c(SO42-)=1mol/L,所带电荷数SO42-是Na+的
倍,故C错误;
D.混合溶液中存在c(Cl-)+2c(SO42-)=c(Na+),SO42- 与Cl-的物质的量之和小于于Na+的物质的量,故D错误.
故选A.
| 3 |
| 5 |
A.如c(Cl-)=3moL/L,则c(SO42-)=1mol/L,则Na2SO4 和NaCl的物质的量之比为1:3,故A正确;
B.溶液浓度和体积未知,不能确定物质的量大小关系,故B错误;
C.如c(Na+)=5mol/L,则c(SO42-)=1mol/L,所带电荷数SO42-是Na+的
| 2 |
| 5 |
D.混合溶液中存在c(Cl-)+2c(SO42-)=c(Na+),SO42- 与Cl-的物质的量之和小于于Na+的物质的量,故D错误.
故选A.
点评:本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从守恒的角度解答该题,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
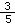 倍,下列叙述中正确的是( )
倍,下列叙述中正确的是( ) 倍,下列叙述中正确的是( )
倍,下列叙述中正确的是( )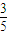 倍
倍