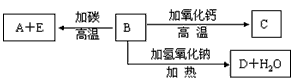
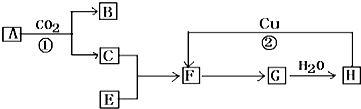
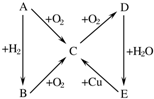
题目内容
(4分)氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是____________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g),若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(1)基态氮原子的价电子排布式是____________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g),若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6分)(1)2s22p3 (1分) (2)①三角锥型(1分) sp3(2分) ②3 (2分)
(1)根据构造原理可知,态氮原子的价电子排布式是2s22p3。
(2)①氨气分子中中心原子含有的孤对电子是(5-1×3)÷2=1,所以氨气是三角锥形结构,氮原子是sp3杂化。而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,所以N2H4分子中氮原子轨道的杂化类型也是sp3杂化。
②反应中有4 mol N—H键断裂,则根据方程式可知,形成1.5mol氮气。氮气中含有氮氮三键,而三键是由1个δ键和2个π键构成的,是由形成的π键是1.5mol×2=3mol。
(2)①氨气分子中中心原子含有的孤对电子是(5-1×3)÷2=1,所以氨气是三角锥形结构,氮原子是sp3杂化。而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,所以N2H4分子中氮原子轨道的杂化类型也是sp3杂化。
②反应中有4 mol N—H键断裂,则根据方程式可知,形成1.5mol氮气。氮气中含有氮氮三键,而三键是由1个δ键和2个π键构成的,是由形成的π键是1.5mol×2=3mol。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
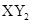 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5