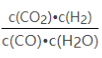题目内容
【题目】肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,![]() (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。

(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________。
【答案】 大于 0.25 3N2H4![]() 4NH3+N2 小于 肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小
4NH3+N2 小于 肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小
【解析】(1)①N2H4(g)![]() N2(g)+2H2(g) 为分解反应,属于吸热反应,△H1>0;②N2(g)+3H2(g)
N2(g)+2H2(g) 为分解反应,属于吸热反应,△H1>0;②N2(g)+3H2(g)![]() 2NH3(g) 为化合反应,属于放热反应,△H2<0,反应热△H1大于△H2。设反应的N2H4的物质的量为y,
2NH3(g) 为化合反应,属于放热反应,△H2<0,反应热△H1大于△H2。设反应的N2H4的物质的量为y,
N2H4(g)![]() N2(g)+2H2(g)
N2(g)+2H2(g)
起始(mol)1 0 0
反应 y y 2y
平衡 1-y y 2y
则![]() =
=![]() =3.0,解得y=0.5mol,因此K=
=3.0,解得y=0.5mol,因此K=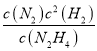 =
=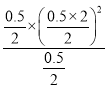 =0.25,故答案为:大于;0.25;
=0.25,故答案为:大于;0.25;
(2)①气态肼在催化剂作用下分解只产生两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝色,可推断两种气体分别为N2和NH3,反应方程式为:3N2H4![]() N2+4NH3,故答案为:3N2H4
N2+4NH3,故答案为:3N2H4![]() N2+4NH3;
N2+4NH3;
②反应为气体物质的量增大的反应,减小压强有利于化学平衡向正反应方向移动,达到平衡时,肼的体积分数减小,根据图像,压强大小关系为:p2<p1,故答案为:小于;
③N2H4的平衡体积分数随温度升高而降低,可能的原因为肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小,故答案为:肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小。