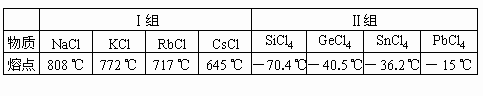题目内容
这里有两组关于物质熔点的数据:

(1)Ⅰ组物质的熔点比Ⅱ组物质的熔点________,原因是________.
(2)Ⅱ组内物质比较,熔点变化由高到低的顺序为________,理由是________.
(3)Ⅰ组内物质比较,发现该组物质的熔点由________键决定,该键的强弱可能与________有关.
解析:
|
(1)高 Ⅰ组物质是离子化合物,熔点由离子键决定,Ⅱ组物质由分子构成,熔化时克服的是分子间作用力 (2)SiI4>SiBr4>SiCl4>SiF4 组成和结构相似的物质,相对分子质量越大,分子间作用力越强,熔点越高 (3)离子 卤离子半径 |

有两组关于物质熔点的数据
|
Ⅰ组 |
||||
|
物质 |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点 |
808℃ |
772℃ |
717℃ |
645℃ |
|
Ⅱ组 |
||||
|
物质 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点 |
-70.4℃ |
-49.5℃ |
-36.2℃ |
-15℃ |
分析以上数据,回答:
(1)有什么规律可循?
答:________。
(2)造成这些规律的主要原因是什么?
答:________。
| Ⅰ组 | |||
物质 | NaCl | KCl | RbCl | CsCl |
熔点 | 808 ℃ | 772 ℃ | 717 ℃ | 645 ℃ |
Ⅱ组 | ||||
物质 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
熔点 | -70.4 ℃ | -49.5 ℃ | -36.2 ℃ | -15 ℃ |
分析以上数据,回答:
(1)有什么规律可循___________________________________________________。
(2)造成这些规律的主要原因是__________________________________________。
有两组关于物质熔点的数据:
| Ⅰ组 | ||||
| 物质 | NaCl | KCl | RbCl | CsCl |
| 熔点 | 808 ℃ | 772 ℃ | 717 ℃ | 645 ℃ |
| Ⅱ组 | ||||
| 物质 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点 | -70.4 ℃ | -49.5 ℃ | -36.2 ℃ | -15 ℃ |
分析以上数据,回答:
(1)有什么规律可循__________________________________________________________。
(2)造成这些规律的主要原因是_________________________________________________。