题目内容
某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
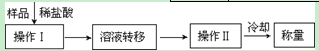
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol?L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol?L-1Ba(OH)2溶液。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,_____。 | |
| 步骤4: | |
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol?L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol?L-1Ba(OH)2溶液。
(本题共12分) (1)由于Ba(OH)2·8H2O与空气中的CO2反应,所取试剂许多已变质为BaCO3,未变质的Ba(OH)2·8H2O在配制溶液时能全部溶解。(2分)
(2)(5分)
(3)搅拌溶解 250ml容量瓶中 (2分)
(4)(2分)0.1980;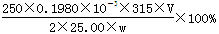
(5)不能。 (1分)
(2)(5分)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,连接带塞导气管将产生的气体导入澄清石灰水中。 | 澄清石灰水变混浊。说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH。 | pH明显大于9.6,说明该试剂中含有Ba(OH)2。 |
(3)搅拌溶解 250ml容量瓶中 (2分)
(4)(2分)0.1980;
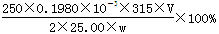
(5)不能。 (1分)
试题分析:(1)Ba(OH)2属于强碱,易吸收空气中的水蒸气和CO2形成难溶的BaCO3沉淀,因此长时间暴露在空气中时Ba(OH)2就有可能转化为BaCO3。
(2)Ba(OH)2易溶于水,所以滤液中含有Ba2+,因此滴加稀硫酸使会产生白色沉淀BaSO4;要想验证沉淀为BaCO3,可以利用其能与酸反应产生能使澄清石灰水变浑浊的CO2气体;为进一步证明试剂是是否还有Ba(OH)2·8H2O,可以取步骤1中的滤液,用pH计测其pH值,若pH>9.6,即证明滤液不是纯BaCO3溶液,即证明是由大量Ba(OH)2·8H2O和少量BaCO3组成,假设成立。
(3)由于试样中含有难溶性的BaCO3,因此加水溶解后要过滤,且冷却后再转移到250ml容量瓶中。
(4)Ba(OH)2溶液的浓度约为0.1mol?L-1,体积是25ml,由于酸式滴定管的容量是50ml,因此盐酸的浓度至少应该是0.1 mol?L-1的.若盐酸的浓度过大,反应过快,不利于控制滴定终点,所以选择0.1980 mol?L-1的盐酸最恰当。消耗盐酸的物质的量是0.1980×V×10-3mol,所以25.00ml溶液中含有Ba(OH)2的物质的量是
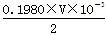 mol,所以w克试样中Ba(OH)2的质量是
mol,所以w克试样中Ba(OH)2的质量是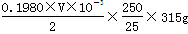 ,故Ba(OH)2·8H2O的质量分数=
,故Ba(OH)2·8H2O的质量分数=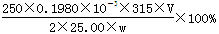 。
。(5)若配制1L1.0 mol?L-1Ba(OH)2溶液,则溶液中溶解的Ba(OH)2·8H2O的质量是315g,所以此时的溶解度约是
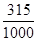 ×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol?L-1Ba(OH)2溶液。
×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol?L-1Ba(OH)2溶液。
练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
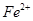 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。