题目内容
在稀硫酸酸化的H2O2溶液中加入乙醚(C2H5 —O—C2H5 )后,溶液分层,再加入少量K2Cr2O7 溶液,并振荡,在乙醚层中出现深蓝色,这是因为生成2CrO5?(C2H5)2O所致,其反应方程式为:Cr2O72- +
4H2O2+2H+ = 2CrO5 + 5H2O
,已知:CrO5 的结构式为: 下列说法正确的是
下列说法正确的是
A.Cr2O72-被氧化成CrO5 B.该反应为氧化还原反应
C.反应中H2O2被还原成H2O D.此反应用于检验Cr2O72-离子的存在
【答案】
D
【解析】
试题分析:根据过氧化铬的结构简式可知,结构中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,所以铬元素的化合价是+6价。而反应前铬元素的化合价也是+6价,这说明该反应不是氧化还原反应,所以选项ABC都是错误的,答案选D。
考点:考查乙醇和重铬酸钾反应的有关判断
点评:该题设计新颖,基础性强,侧重对学生能力的培养。该题的关键是根据CrO5 的结构式准确判断出铬元素的化合价,然后结合题意灵活运用即可。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目




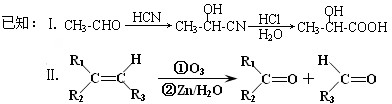
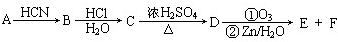
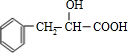
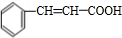 +H2O
+H2O