题目内容
14.(1)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体).将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红.请根据以上事实书写CaH2与水反应的化学方程式CaH2+2H2O=Ca(OH)2+2H2↑.(2)实验室可用MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
①该反应的还原剂是HCl,氧化剂与还原剂的物质的量比是1:2.被氧化的元素是Cl,还原产物是MnCl2.
②若反应中转移了NA个电子,则生成的Cl2在标准状况下的体积是11.2L.
③实验室用12.00mol/L盐酸配制100mL 1mol/L 盐酸,需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有100mL容量瓶、胶头滴管.若定容时俯视刻度线,则配得溶液的浓度偏高(填“偏高”,“偏低”,“不变”).
分析 (1)根据该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,据此书写方程式;
(2)①MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O制备氯气,该反应中元素的化合价变化如下:MnO2→MnCl2,Mn元素由+4价→+2价,所以1MnO2是氧化剂,氧化剂对应的产物是还原产物;2HCl→Cl2,Cl元素由-1价→0价,一个HCl分子失1个电子,所以2HCl是还原剂,据此分析;
②由MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O制备氯气,2HCl→Cl2,则生成1mol氯气则转移2mol电子,据此计算;
③根据实验步骤确定操作所需仪器;根据c=$\frac{n}{V}$结合操作的方法判断误差;
解答 解:(1)因为CaH2加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,则方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑;
(2)①MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O制备氯气,该反应中元素的化合价变化如下:MnO2→MnCl2,Mn元素由+4价→+2价,一个MnO2分子得2个电子,所以MnO2是氧化剂,氧化剂对应的产物MnCl2是还原产物;2HCl→Cl2,所以HCl是还原剂,被氧化的元素是Cl,所以氧化剂与还原剂的物质的量比是1:2,
故答案为:HCl;1:2; Cl;MnCl2;
②由MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O制备氯气,2HCl→Cl2,则生成1mol氯气则转移2mol电子,所以若反应中转移了NA个电子,则生成的Cl2在标准状况下的体积是0.5mol×22.4mol/L=11.2L,故答案为:11.2L;
③用12.00mol/L盐酸配制100mL 1mol/L盐酸,可用量筒量取一定体积的浓硫酸,在烧杯中加水稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,并洗涤烧杯,将洗涤液一并转移到容量瓶中,加入蒸馏水至刻度线2~3cm时,改用教头滴管定容,则需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有100mL容量瓶、胶头滴管;若定容时俯视刻度线,则导致体积偏小,所以配得溶液的浓度偏高,故答案为:100mL容量瓶、胶头滴管;偏高.
点评 本题考查较为综合,涉及氧化还原反应的分析以及溶液的配制,侧重于学生的分析能力和实验能力的考查,难度不大,注意相关基础知识的积累.

| A. | 中子数为8的碳原子:12C | B. | HF的电子式: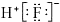 | ||
| C. | Cl-的结构示意图: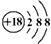 | D. | CH4分子的比例模型: |
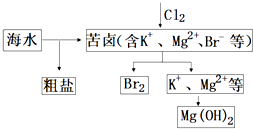
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 获取金属Mg可采用电解MgCl2溶液的方法 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 | |
| D. | 粗盐可采用除杂和重结晶等过程提纯 |
| A. | 1molFe和足量的足量的氯气完全反应,共失去3mol电子 | |
| B. | 含NA个氧原子的氧气在标准状况下的体积为11.2L | |
| C. | 1molNa原子中约含有11NA个电子 | |
| D. | 1个氢气分子的实际重量约为$\frac{1}{{N}_{A}}$g |
| A. | 单质钠熔点低于100℃ | |
| B. | 钠元素只能以化合态存在于自然界 | |
| C. | Na与Na+都具有强的还原性 | |
| D. | 金属钠具有好的导电性,但日常中不用作导线 |
| A. | 胶体区别于其他分散系的本质特征是分散质微粒直径在10-9~10-7m之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体时,均能产生丁达尔现象 | |
| C. | 向豆浆中加入盐卤做豆腐是胶体聚沉在生活中的具体应用 | |
| D. | 溶液、胶体、浊液均属于混合物 |
| A. | O | B. | F | C. | P | D. | Cl |
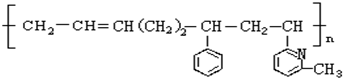
其单体可能是以下6种中的正确的组合是( )
①
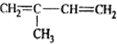 ②
②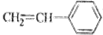 ③CH2=CH-CH=CH2④
③CH2=CH-CH=CH2④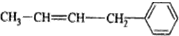 ⑤
⑤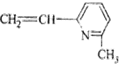 ⑥
⑥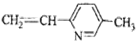
| A. | ②③⑤ | B. | ②③⑥ | C. | ①②⑥ | D. | ②④⑥ |
| A. | Na2O可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |