题目内容
下列说法不正确的是
| A.用氢氧化钠溶液滴定食醋,开始时溶液的pH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃。 |
| B.硝酸钾饱和溶液冷却未出现结晶时,可以用玻璃棒充分磨擦器皿壁促使晶体析出。 |
| C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快。 |
D.Cu2+与过量氨水反应制取Cu(OH)2,离子方程式为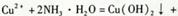 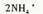 |
D
解析试题分析:A.用氢氧化钠溶液滴定食醋,开始时由于溶液中的食醋被OH-中和但溶液中H+浓度变化较小,使用溶液的pH变化缓慢,当接近恰好完全反应时,少滴加一滴溶液呈酸性,多滴加一滴时溶液呈碱性,元素常数溶液的pH出现大的变化,称为滴定突变,也叫滴定突跃。正确。B. 晶体无法找一个“中心”聚集起来.要使过饱和溶液析出晶体,可采取下列方法①加入晶体 ②摩擦烧杯壁,产生玻璃碎末 ③过度冷却 ④用玻璃棒搅拌,使溶质在玻璃棒上结晶.正确。C.当使用抽滤装置时,抽气泵给吸滤瓶减压,导致装置内部的压强降低,物质在外界大气压强的作用下。由于重力作用很快就过滤出来。因而使过滤的速度加快。正确。D.Cu2+与少量氨水反应制取Cu(OH)2,离子方程式为Cu2++2 NH3·H2O= Cu(OH)2↓+ 2NH3+。当氨水过量时又发生反应:Cu(OH)2+4NH3·H2O="[" Cu(NH3)4] 2++2OH-+4H2O.沉淀有溶解。错误。
考点:考查过滤、结晶、酸碱中和滴定时溶液的PH的变化及离子方程式的书写的知识。

下列实验现象、解释与结论均正确的是
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
| B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该沉淀可能是BaSO4,该溶液中可能含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
下列实验事实不能证明醋酸是弱酸的是
| A.常温下,测得醋酸钠溶液的pH>7 |
| B.常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等 |
| C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快 |
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是 ,
| A.pH=3的硝酸和pH=11的氢氧化钠溶液 |
| B.pH=3的盐酸和pH=11的氨水 |
| C.pH=3的硫酸和pH=11的氢氧化钠溶液 |
| D.pH=3的醋酸和pH=11的氢氧化钠溶液 |
常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是 ( )。
| A.HX和CH3COOH均可抑制水的电离 |
| B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1 |
| C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者 |
常温下,0.1 mol/L氨水溶液中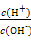 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )
| A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L |
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S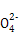 ) ) |
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
已知298 K时下列物质的溶度积(单位略)。
| | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的CrO42—和Cl-的溶液中慢慢滴入AgNO3溶液时,CrO42—先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度: c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
常温下,有关醋酸溶液的叙述中错误的是(双选) ( )。
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
B.将pH=3的醋酸稀释为pH=4的过程中,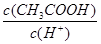 比值不变 比值不变 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.a mL pH=3的醋酸溶液与b mL pH=11的NaOH溶液恰好完全中和时,a=b |