题目内容
5.淡黄色的草酸亚铁晶体A(化学式为FeC2O4•xH2O;式量为144+18x)常用于照相显影剂及制药工业,已知晶体A在空气中加热到不同温度,会得到铁的不同价态的氧化物.在t1温度反应下:4FeC2O4•xH2O+3M=2Fe2O3+8CO2+4xH2O.(1)M的化学式是O2;
(2)标准状况下每生成2.24L CO2消耗的晶体A质量为9g,则x的值为2.
(3)为验证Fe2O3中铁元素的价态,应先加入足量稀盐酸酸溶,该反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(4)已知在t2温度时生成铁的氧化物中既有+2价又有+3价,盐酸酸溶后将溶液等分为A、B两份,向A中加入几滴的KSCN溶液,看到的现象是溶液变红;为验证该溶液中还含有+2价铁,应向B中加入的试剂是酸性高锰酸钾溶液.
分析 (1)根据质量守恒定律判断M的化学式;
(2)根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,再根据反应得出消耗A的物质的量,再根据m=nM计算出x;
(3)氧化铁与稀盐酸反应生成氯化铁和水,据此写出反应的离子方程式;
(4)溶液中含有+2价和+3价的铁离子,需要用硫氰化钾具有铁离子,用酸性高锰酸钾溶液检验亚铁离子,据此进行解答.
解答 解:(1)根据反应4FeC2O4•xH2O+3M=2Fe2O3+8CO2+4xH2O及质量守恒可知,M为氧气,化学式为:O2,
故答案为:O2;
(2)标况下2.24L二氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,根据反应4FeC2O4•xH2O+3M=2Fe2O3+8CO2+4xH2O可知,生成0.1mol二氧化碳气体消耗A的物质的量为:0.1mol×$\frac{1}{2}$=0.05mol,则:(144+18x)g/mol×0.05mol=9g,解得:x=2,
故答案为:2;
(3)氧化铁与稀盐酸反应的离子反应为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(4)铁离子与硫氰化钾反应生成络合物硫氰化铁,溶液变成红色,所以向A中加入几滴的KSCN溶液,看到的现象是溶液变红;
KMnO4溶液能氧化Fe2+,高锰酸钾溶液的紫色褪去,向溶液中加入少量KMnO4溶液,紫色褪去,则证明溶液中含有Fe2+,
故答案为:溶液变红;酸性高锰酸钾溶液.
点评 本题考查了化学式的确定、离子方程式的书写、铁离子和亚铁离子的检验方法,题目难度中等,注意掌握检验铁离子、亚铁离子常用方法,明确质量守恒定律在确定化学式中的应用,能够正确书写常见反应的离子方程式.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 乙醇能溶解很多有机物和无机物,可用乙醇提取中药中的有效成分 | |
| C. | 乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒 | |
| D. | 乙醇容易挥发,所以才有“酒香不怕巷子深”的俗语 |
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 将溴水加入苯中,震荡,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的混合物共1 mol,完全燃烧生成3 mol H2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为2NA |
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
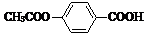
Ⅰ.制备溴苯
(1)装置中长导管a的作用是冷凝回流、导出气体.
(2)本实验所获得的溴苯为褐色,是因为溴苯溶解了过量的溴.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃.同学们设计了如图2流程:
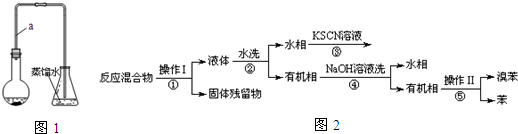
(3)操作Ⅱ为蒸馏.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、分液漏斗;流程③的现象为溶液变血红色(或红色),流程④的作用是除去溴苯中的溴.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr.你认为该同学的判断不合理(填“合理”、“不合理”).
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
. | 事实 | 结论 |
| A.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘元素 |
| D.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体 | |
| D. | 乙烯与溴的四氯化碳溶液反应 |