题目内容
如图所示,已知:
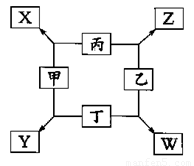
①甲、乙、丙、丁均为前三周期元素的单质,甲、乙、 丙常温下为气体。
②在一定条件下甲与丙和甲与丁都按物质量之比l:3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)W的电子式为 ;
(2)X与乙催化氧化的化学方程式是______________________________________________;
(3)Y与Z反应的化学方程式是_____________________________________________;
(4)2.4g丁与足量的乙反应生成W放出QkJ的热,则该反应的热化学方程式为 ;
(5)实验室制取丙的离子方程式为 。
(1)
 (2分)
(2分)
(2)4NH3+5O2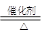 4NO+6H2O
(2分)
4NO+6H2O
(2分)
(3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑(2分,产物写成NH3·H2O也对。)
(4)2Mg(s)+O2(g)= 2MgO(s) △H=-20QkJ·mol-1(2分)
(5)Zn+2H+=Zn2++H2↑(2分)
【解析】
试题分析:甲、乙、丙均为前三周期元素的气体单质,可能为H2、O2、N2、Cl2,在一定条件下甲与丙、甲与丁都按微粒个数比1:3组成X和Y,在产物中元素甲呈负价,丙和丁显正价,说明甲是非金属元素形成的单质N2,丙为H2,X为NH3,Y为Mg3N2;在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,在产物中元素乙呈负价,说明乙是非金属元素.所以乙为O2,分别生成Z为H2O,W为MgO。
W为MgO含离子键,可写出电子式。
X为NH3,乙为O2,催化氧化生成NO、H2O,4NH3+5O2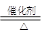 4NO+6H2O
4NO+6H2O
Y为Mg3N2,Z为H2O,发生水解反应:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
2.4gMg为0.1mol,化学方程式中Mg的系数为2,所以∆H-20QkJ·mol-1,进而写出热化学方程式:2Mg(s)+O2(g) = 2MgO(s) △H=-20QkJ·mol-1。
丙为H2,实验室制取氢气的离子方程式为:Zn+2H+=Zn2++H2↑。
考点:本题考查无机物的推断、化学用语及方程式的书写。

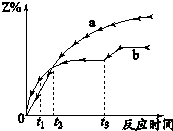 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A、曲线a是500℃时的图象 | ||
B、从0到t1时刻,反应物X(g)的
| ||
C、t2时刻生成物Z的量
| ||
| D、t3时刻改变的条件可能是降温 |
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:
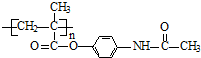 .
.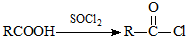

 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式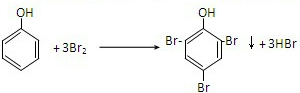



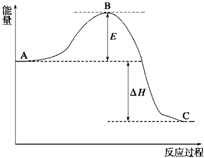 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.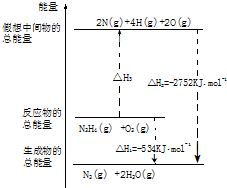 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.