题目内容
X、Y、Z、W、R五种短周期非金属主族元素在元素周期表中的位置如图所示,下列说法中正确的是( )
| X | Y | ||
| Z | W | R |
| A、Z位于第三周期VA族 |
| B、X、Y的气态氢化物的稳定性:X>Y |
| C、原子半径大小顺序:Z>W>Y |
| D、W、R的最高价氧化物对应水化物的酸性:W>R |
分析:根据X、Y、Z、W、R五种短周期非金属主族元素在元素周期表中的位置知,这两个周期是第二、三周期,且X是N元素、Y是O元素、Z是Si元素、W是S元素、R是Cl元素,
A.主族元素中,其族序数和最外层电子数相等;
B.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;
C.原子的电子层数越多其原子半径越大,即原子的周期数越大其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
D.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强.
A.主族元素中,其族序数和最外层电子数相等;
B.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;
C.原子的电子层数越多其原子半径越大,即原子的周期数越大其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
D.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:解:根据X、Y、Z、W、R五种短周期非金属主族元素在元素周期表中的位置知,这两个周期是第二、三周期,且X是N元素、Y是O元素、Z是Si元素、W是S元素、R是Cl元素,
A.Z是Si元素,Si原子结构示意图为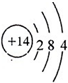 ,所以Z位于第三周期第IVA族,故A错误;
,所以Z位于第三周期第IVA族,故A错误;
B.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,Y的非金属性大于X,所以X、Y的气态氢化物的稳定性:X<Y,故B错误;
C.原子的电子层数越多其原子半径越大,即原子的周期数越大其原子半径越大,Y属于第二周期,Z、W属于第三周期,且Z的原子序数小于W,所以原子半径大小顺序是Z>W>Y,故C正确;
D.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,S元素的非金属性小于Cl元素,所以二者的最高价氧化物的水化物酸性:H2SO4<HClO4,故D错误;
故选C.
A.Z是Si元素,Si原子结构示意图为
 ,所以Z位于第三周期第IVA族,故A错误;
,所以Z位于第三周期第IVA族,故A错误;B.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,Y的非金属性大于X,所以X、Y的气态氢化物的稳定性:X<Y,故B错误;
C.原子的电子层数越多其原子半径越大,即原子的周期数越大其原子半径越大,Y属于第二周期,Z、W属于第三周期,且Z的原子序数小于W,所以原子半径大小顺序是Z>W>Y,故C正确;
D.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,S元素的非金属性小于Cl元素,所以二者的最高价氧化物的水化物酸性:H2SO4<HClO4,故D错误;
故选C.
点评:本题考查了元素位置、结构的关系及应用,正确推断元素是解本题关键,结合元素周期律来分析解答,易错选项是D,注意根据元素非金属性强弱确定酸性强弱时,必须是最高价氧化物的水化物的酸性强弱,为易错点.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
