题目内容
(18分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
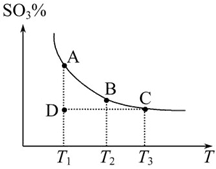
2SO2(g)+O2(g)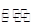 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)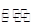 2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
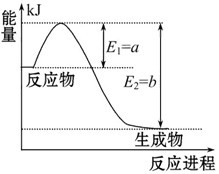
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4 mol·L-1硝酸银溶液, 白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
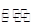 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)
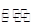 2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)

(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4 mol·L-1硝酸银溶液, 白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
(1)①放热(2分) 不(2分)
②> (2分) >(2分)
(2)N2(g)+3H2(g)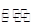 2NH3(g) ΔH ="2(a-b)" kJ·mol-1(3分)
2NH3(g) ΔH ="2(a-b)" kJ·mol-1(3分)
(3)有(1分)Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成(2分)
白色沉淀转化为黄色沉淀(2分)AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)(2分)
②> (2分) >(2分)
(2)N2(g)+3H2(g)
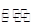 2NH3(g) ΔH ="2(a-b)" kJ·mol-1(3分)
2NH3(g) ΔH ="2(a-b)" kJ·mol-1(3分)(3)有(1分)Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成(2分)
白色沉淀转化为黄色沉淀(2分)AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)(2分)
试题分析:(1)①由图可知,温度越高,三氧化硫的含量越低,平衡向左移动,正反应放热;恒温、恒容条件下充入氦气,体积增不变,正逆反应速率不变,所以平衡不移动。
②温度越高,平衡越向左移动,平衡常数越小,故 K1>K2。状态D未达到平衡状态,要达到平衡状态,三氧化硫的含量要增大,即平衡需要向右移动,故v(正)>v(逆)。
(2)由图像可知N2和H2反应生成1 mol NH3的反应热为-(b-a) kJ·mol-1,可得热化学方程式为:N2(g)+3H2(g)
 2NH3(g) ΔH ="2(a-b)" kJ·mol-1
2NH3(g) ΔH ="2(a-b)" kJ·mol-1(3)通过计算比较浓度熵与Ksp的大小,Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成;沉淀向溶度积更小的方向转化,Ksp(AgCl)>Ksp(AgI),所以AgCl沉淀转化为更难溶的AgI,所以实验现象为白色沉淀转化为黄色沉淀;离子方程式为:AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)。

练习册系列答案
相关题目
 cC(g),若T1>T2, 则a +b=c且 ?H<0
cC(g),若T1>T2, 则a +b=c且 ?H<0 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是 2AB(g)达到平衡的标志是 ( )
2AB(g)达到平衡的标志是 ( ) 2SO3下列判断正确的是
2SO3下列判断正确的是 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系