题目内容
【题目】自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
温度/℃ | 1538 | 1760 | 2404 |
平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
①该反应的△H______0。(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,请 补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。________________

(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)![]() 2NO(g)达到平衡时NO的浓度和O2的转化率。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)_____________
2NO(g)达到平衡时NO的浓度和O2的转化率。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)_____________
【答案】A > 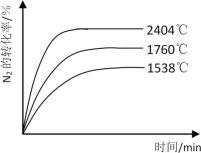 0.20mol/L,3.8%
0.20mol/L,3.8%
【解析】
(1)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO,说明该反应难以进行,反应的活化能高;
(2)①依据温度不同平衡常数的变化,判断升温化学平衡移动方向判断反应的吸热放热;
②依据温度升高达到平衡所需要时间减小,氮气转化率增大;画出图象变化;
(3)依据2404℃时的平衡常数,结合化学平衡的三段式列式计算。
(1)闪电或者高温,主要是提供能量给N2分子,让其破坏变成氮原子,因此,只能说明引发反应所需要的能量高即活化能高,不能说明反应吸收的能量高,
故本题的正确答案为A。
(2)①在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,故△H>0;
2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,故△H>0;
②1760℃、2404℃时N2的转化率随时间变化的示意图,根据温度越高平衡需要时间越短,氮气转化率越大,不难画出图像。
 ,
,
故本题的正确答案为: ;
;
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)![]() 2NO(g);
2NO(g);
依据化学平衡的三段式计算列式计算,设达到平衡时NO的浓度为2x,则
N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始量(mol) 2.6 2.6 0
变化量(mol) x x 2x
平衡量(mol) 2.6-x 2.6-x 2x
平衡浓度为c(N2)=(2.6-x)mol/L,c(O2)=(2.6-x)mol/L,c(NO)=2x mol/L;
2404℃时化学平衡常数K=64×10-4
K=![]() =
=![]() =64×10-4,
=64×10-4,
解得x=0.10mol,则平衡时NO的浓度0.20mol/L;
O2的转化率=![]() ×100%=3.8%,
×100%=3.8%,
故答案为:0.20mol/L;3.8%。

【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛应用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:___________;浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿目的是______________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。



