题目内容
17.下列化学用语正确的是( )| A. | 氮气的电子式: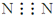 | |
| B. | 乙酸乙酯的结构简式:C4H8O2 | |
| C. | O2-的结构示意图: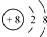 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
分析 A.氮气的电子式中漏掉了氮原子的1对未成键电子;
B.乙酸乙酯中含有酯基,结构简式中需要标出官能团结构;
C.氧离子的核电荷数为8,核外电子总数为10;
D.氢氧化钡在溶液中完全电离出钡离子和氢氧根离子,氢氧根离子的表示方法错误.
解答 解:A.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为: ,故A错误;
,故A错误;
B.乙酸乙酯的结构简式中需要标出含有的官能团结构,则乙酸乙酯正确的结构简式为:CH3COOCH2CH3,故B错误;
C.O2-的核电荷数为8,最外层得到8电子稳定结构,其离子结构示意图为: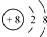 ,故C正确;
,故C正确;
D.氢氧化钡为强电解质,在溶液中完全电离,其正确的电离方程式为:的电离方程式:Ba(OH)2═Ba2++2OH-,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及离子结构示意图、电子式、电离方程式、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
8.下列图式表示正确的是( )
| A. | 二氧化碳 | B. | 次氯酸的结构式 H-Cl-O | ||
| C. | 铝离子的结构示意图 | D. | 基态碳原子的价电子排布图为 |
5.2013年12月上旬,江苏省大部分地区遭受有史以来最为严重的雾霾天气.雾霾属于下列哪种分散系( )
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
12.对于反应2SO2+O2?2SO3,下列说法正确的是( )
| A. | 工业上常使用过量的空气,目的是为了使SO2的转化率达100% | |
| B. | 工业上选用V2O5作该反应的催化剂,目的是为了加快化学反应速率 | |
| C. | 工业上常选用常压,原因是增大压强不能改变该反应的化学反应速率 | |
| D. | 升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好 |
2.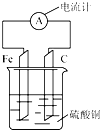 将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )
将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )
 将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )
将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )| A. | 铁片是正极 | |
| B. | 一段时间后,碳棒质量增加 | |
| C. | 该装置能将电能转化为化学能 | |
| D. | 外电路中电子由碳棒流出经过电流计流向铁片 |
6.下列物质分类中,前者包含后者的是( )
| A. | 酸性氧化物 非金属氧化物 | B. | 溶液 胶体 | ||
| C. | 化合物 电解质 | D. | 有机物 分散系 |
 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: