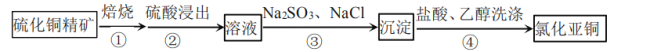题目内容
【题目】某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
Fe +H2O![]() FeO+H2 3Fe + 4H2O
FeO+H2 3Fe + 4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
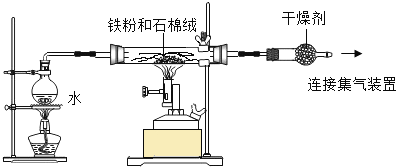
实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
(1)实验过程中,应先点燃___________(选填“酒精灯”或“酒精喷灯”);目的是__________________,装置中石棉绒的作用是_____________________。
(2)若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是___________g。
实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
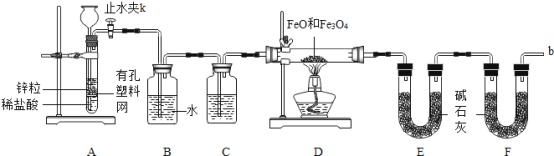
(1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差__________,则气密性良好。
(2)装置A中发生的反应方程式_______________________________________。
(3)为了安全,在点燃酒精灯之前,在F装置出口b处必须______________________。
(4)装置C中所放试剂为_________,装置B的作用是_________________________。
(5)干燥管E右边又连接干燥管F的目的是_________________________________。
若无干燥管F,测得Fe3O4的质量将_______________(填“偏大”、“偏小”或“无影响”)。
【答案】酒精灯 先产生水蒸气,排尽空气 增大铁粉与水蒸气接触面积 4.2 不变 Zn+2HCl=ZnCl2+H2↑ 验纯 浓硫酸 除去HCl气体 防止空气中的二氧化碳和水蒸气进去到E装置 偏大
【解析】
实验一:(1)铁能与空气中的氧气发生反应,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积;
(2)分析两个反应可知产生四氧化三铁需要的铁少,因此可依据3Fe+4H2O(g)![]() Fe3O4+4H2,由氢气的质量求出需要铁的质量;
Fe3O4+4H2,由氢气的质量求出需要铁的质量;
实验二:(1)根据检验气密性的方法进行分析解答;
(2)根据锌和盐酸反应产生氯化锌和氢气写出反应方程式;
(3)根据氢气点燃容易发生爆炸分析使用注意事项;
(4)根据产生的氢气会混有杂质,要进行除杂、干燥分析装置的作用;
(5)根据碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会影响实验结果进行分析。
实验一:
(1)铁能与空气中的氧气发生反应,因此为了排除氧气的干扰,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积,故答案为:酒精灯;先产生水蒸气,排尽空气;增大铁粉与水蒸气的接触面积;
(2)在不同温度下发生的反应中,Fe元素化合价均升高,H元素化合价均降低,生成一定量H2时,Fe元素化合价升高越高,则所需Fe的量越少,因此根据生成Fe3O4进行计算最少所需Fe的量,设生成0.2g氢气至少需要铁的质量为x,
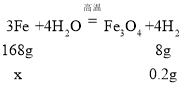 ,则
,则![]() ,解得x=4.2g;
,解得x=4.2g;
实验二:
(1)检查A装置气密性的方法:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,形成的液柱不下降,即液面高度差不变,则气密性良好;
(2)锌和盐酸反应产生氯化锌和氢气,故反应的方程式为:Zn+2HCl=ZnCl2+H2↑;
(3)因为氢气在不纯的情况下点燃容易发生爆炸,因此在点燃酒精灯之前,在F装置出口b处必须验纯;
(4)产生的氢气会混有氯化氢和水蒸气,因此要先通过水除去氯化氢,再通过浓硫酸除去水蒸气;故答案为:浓硫酸;除去HCl气体;
(5)碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会使测定生成的水多,使测定的结果偏大;故答案为:防止空气中的二氧化碳和水被E吸收;偏大。

 阅读快车系列答案
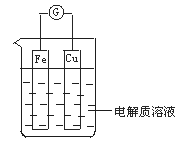
阅读快车系列答案【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。