题目内容
(2013?珠海模拟)对于常温下pH=3的乙酸溶液,下列说法正确的是( )
分析:乙酸是弱电解质,溶液中存在电离平衡;
A、依据溶液中电荷守恒分析判断;
B、乙酸是弱电解质存在电离平衡,加水稀释促进电离;
C、依据电离平衡移动方向分析判断;
D、乙酸是弱酸反应后会继续电离;
A、依据溶液中电荷守恒分析判断;
B、乙酸是弱电解质存在电离平衡,加水稀释促进电离;
C、依据电离平衡移动方向分析判断;
D、乙酸是弱酸反应后会继续电离;
解答:解:A、常温下pH=3的乙酸溶液,存在电荷守恒为:C(H+)=c(CH3COO-)+c(OH-),故A正确;
B、加水稀释到原体积的10倍后溶液pH变为4,但乙酸是弱电解质存在电离平衡,稀释促进电离,溶液又电离出氢离子,浓度增大,溶液PH小于4,故B错误;
C、乙酸钠溶于水溶液中的乙酸根离子抑制乙酸的电离,平衡左移,氢离子浓度减小,溶液PH增大,故C正确;
D、pH=3的乙酸溶液与等体积pH=11的NaOH溶液混合时,醋酸过量所得溶液中是醋酸钠和醋酸的混合溶液:c(Na+)<c(CH3COO- )故D错误;
故选AC.
B、加水稀释到原体积的10倍后溶液pH变为4,但乙酸是弱电解质存在电离平衡,稀释促进电离,溶液又电离出氢离子,浓度增大,溶液PH小于4,故B错误;
C、乙酸钠溶于水溶液中的乙酸根离子抑制乙酸的电离,平衡左移,氢离子浓度减小,溶液PH增大,故C正确;
D、pH=3的乙酸溶液与等体积pH=11的NaOH溶液混合时,醋酸过量所得溶液中是醋酸钠和醋酸的混合溶液:c(Na+)<c(CH3COO- )故D错误;
故选AC.
点评:本题考查了弱电解质的电离平衡分析判断,溶液中电荷守恒的应用,影响因素的分析,酸碱反应的定量分析计算,溶液稀释后PH的计算判断,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
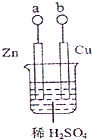 (2013?珠海模拟)某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
(2013?珠海模拟)某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )