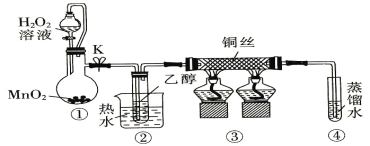
题目内容
【题目】已知反应:①C(s)+O2(g)=CO2(g)△H1;
②C(s)+![]() O2(s)=CO(g)△H2;
O2(s)=CO(g)△H2;
③CO2(g)+C(s)=2CO(g)△H3;
④4Fe(s)+3O2(g)=2Fe2O3(s)△H4;
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列判断正确的是( )
A.△H4是Fe的燃烧热
B.△H1>△H2
C.△H3=2△H2-△H1
D.3△H1-3△H2-![]() △H4+△H5=0
△H4+△H5=0
【答案】C
【解析】
A.一定条件下,1mol纯物质完全燃烧生成稳定的氧化物释放的热量叫做燃烧热,根据反应④,Fe的计量系数不是1,则△H4是Fe的燃烧热,另外铁在氧气中燃烧的产物是四氧化三铁,故A错误;
B.反应①、②都是燃烧,燃烧都是放热反应,△H<0,反应①为完全燃烧,反应②为不完全燃烧,完全燃烧放出的热量更多,△H1<△H2,故B错误;
C.根据盖斯定律,③=②×2-①,则△H3=2△H2-△H1,故C正确;
D.根据盖斯定律,①×3-②×3-④×![]() =⑤,可得3△H1-3△H2-
=⑤,可得3△H1-3△H2-![]() △H4-△H5=0,故D错误;
△H4-△H5=0,故D错误;
答案选C。

练习册系列答案
相关题目