题目内容
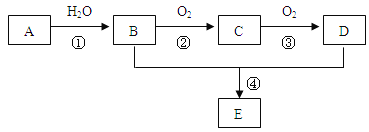
【题目】KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:

(1) 检验“含碘废水”中含有的单质I2,常用的试剂是________。
(2) 进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加________盐溶液来检验其是否已洗涤干净。
(3) “滤渣2”的成分为____________(填化学式)。
(4) “制KI”时,发生反应的化学方程式为____________。
(5) 江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33 mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000 g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00 mL 6.000×10-4 mol·L-1 Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O; I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
_______
②该食盐试样是否符合江苏食用加碘盐新标准并说明判断依据。
_______
【答案】淀粉溶液BaCl2[或Ba(NO3)2]Cu(或Cu和Fe)K2CO3+FeI2===FeCO3↓+2KIKIO3~6Na2S2O3
n(I)=n(KIO3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×6.000×10-4 mol·L-1×12.00 mL×10-3 L·mL-1
×6.000×10-4 mol·L-1×12.00 mL×10-3 L·mL-1
=1.200×10-6 mol
m(I)=1.200×10-6 mol×127 g·mol-1×103 mg·g-1=0.152 4 mg
碘含量为:![]() =38.10 mg/kg不符合新标准。因为38.10 mg/kg不在18~33 mg/kg范围内
=38.10 mg/kg不符合新标准。因为38.10 mg/kg不在18~33 mg/kg范围内
【解析】试题分析:本题以碘酸钾的制备为载体,考查考生对化学实验基础知识的掌握情况、简单化工工艺的理解和简单定量实验的分析能力。
解析:流程中第一步是还原I2单质生成CuI,反应同时生成硫酸盐;过滤分离后用沉淀CuI与Fe反应制备FeI2;再将FeI2与K2CO3反应制取KIO3,经分离得到产品。
(1)因为I2遇淀粉后溶液变成蓝色,因此检验I2常用淀粉。答案:淀粉。(2)“过滤1”操作之前溶液中主要含有硫酸盐,所以只要洗涤滤液中没有SO42-就表示沉淀已经洗涤干净,检验SO42-离子常用的试剂是BaCl2溶液等可溶性钡盐溶液和稀硝酸(或稀盐酸),滴加的盐溶液应当是BaCl2或Ba(NO3)2等。正确答案:BaCl2或Ba(NO3)2。(3)2CuI+Fe=FeI2+2Cu,所以“过滤2”得到的“滤渣2”是Cu和Fe的混合物,也有可能Fe恰好完全反应时“滤渣2”只含有Cu。正确答案:“Cu和Fe”或“Cu”。(4)“制取KI”的原料是K2CO3和FeI2,反应生成KI时,另一产物是FeCO3,根据离子反应发生的条件,由于该反应明显没有得到难电离产物、气体,也不是氧化还原反应,所以一定有沉淀产生,因此FeCO3是一种不溶于水的产物。正确答案:K2CO3+FeI2=FeCO3↓+2KI 。(5)根据题目提供的反应原理可得KIO3→6Na2S2O3,n(KIO3)=![]() ×n(Na2S2O3)=
×n(Na2S2O3)=![]() ×6.000×10-4mol/L×0.01200L=1.2×10-6mol,碘元素含量为:
×6.000×10-4mol/L×0.01200L=1.2×10-6mol,碘元素含量为:![]() =0.0381g/kg=38.1mg/kg。答案:①结果38.1mg/kg;②38.1mg/kg>33mg/kg,所以该食盐试样不符合标准。
=0.0381g/kg=38.1mg/kg。答案:①结果38.1mg/kg;②38.1mg/kg>33mg/kg,所以该食盐试样不符合标准。

 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是( )
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
A.A
B.B
C.C
D.D