题目内容
世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和 我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同
我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同 时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
时会产生Cl2.该法制ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)该反应中,氧化剂为____________,氧化产物为____________.
(2)若反应生成0.1mol Cl2,则转移的电子的物质的量为____________.
(3)盐酸在反应中显示出来的性质是:(填写编号)____________.
①还原性 ②还原性、酸性 ③氧化性 ④氧化性、酸性.
(4)由化学方程式可以推出:还原性大小比较:HCl>____________
定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
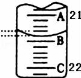
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。


 示溶液中c(H+)和c(O
示溶液中c(H+)和c(O H-)的关系,下列判断错误的是:
H-)的关系,下列判断错误的是:
 应的化学方程式为:3Cu+8HNO3=3Cu(NO
应的化学方程式为:3Cu+8HNO3=3Cu(NO 学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是( )
学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是( ) 、K+、S2-、Na+ B.Mg2+、N
、K+、S2-、Na+ B.Mg2+、N 、OH-、Cl-
、OH-、Cl- D.Na+、OH-、Cl-、N
D.Na+、OH-、Cl-、N