题目内容
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.25℃时,l L pH=13的Ba(OH)2 溶液中含 Ba2+的数目为0.1NA
C.12g金刚石中含有的共价键数为2NA
D.7.1g氯气与足量热烧碱溶液反应,转移电子数为0.2NA
练习册系列答案
相关题目
9.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.因而金属的防护工作特别重要.下列对几种常见金属防腐方法的描述错误的是( )
| 选项 | 方法 | 对相应方法的描述 |
| A | 改变金属内部的组成结构 | 此法实际上是将金属制成合金,增强抗腐蚀能力 |
| B | 在金属表面覆盖保护层 | 保护层破损后,就完全失去了对金属的保护作用 |
| C | 外加电流的阴极保护法 | 接外加直流电源构成电解池,被保护的金属作阴极 |
| D | 牺牲阳极的阴极保护法 | 构成原电池,被保护的金属作正极 |
| A. | A | B. | B | C. | C | D. | D |
4.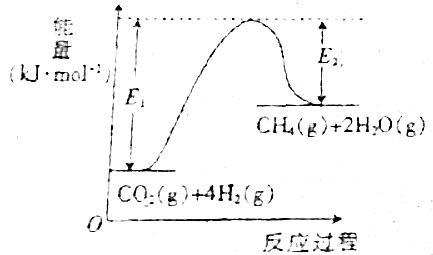 已知可逆反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的能量变化与反应过程的关系如图所示,下列有关说法不正确的是( )
已知可逆反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的能量变化与反应过程的关系如图所示,下列有关说法不正确的是( )
 已知可逆反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的能量变化与反应过程的关系如图所示,下列有关说法不正确的是( )
已知可逆反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的能量变化与反应过程的关系如图所示,下列有关说法不正确的是( )| A. | CO2(g)+4H2(g)→CH4(g)+2H2O(g)的活化能为E1 | |
| B. | CH4(g)+2H2O(g)→CO2(g)+4H2(g)的活化能为E2 | |
| C. | 改可逆反应的反应热为E1-E2 | |
| D. | 正反应为放热反应 |
11.与2.2g C02所含的氧原子数相等的C0质量为 ( )
| A. | 56g | B. | 1.4g | C. | 5.6g | D. | 2.8g |
5.工业上制取CuCl2的生产流程如下:

请结合下表数据,回答问题:
(1)写出下列离子方程式:A→B2H++ClO-+2 Fe2+=2 Fe3++Cl-+H2O; B→C+DCuO+2H+=Cu2++H2O.
(2)溶液A中加入NaClO的目的是将Fe2+氧化为Fe3+,使后一步沉淀Fe(OH)3更彻底.
(3)在溶液B中加入CuO的作用是调节溶液的PH为3~4,使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+.
(4)操作①应控制的pH范围是:大于或等于6.4;操作②的目的是洗涤氢氧化铜表面的可溶性杂质.
(5)抽Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制Cu2+的水解,防止CuCl2晶体中含有Cu(OH)2杂质.

请结合下表数据,回答问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(2)溶液A中加入NaClO的目的是将Fe2+氧化为Fe3+,使后一步沉淀Fe(OH)3更彻底.
(3)在溶液B中加入CuO的作用是调节溶液的PH为3~4,使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+.
(4)操作①应控制的pH范围是:大于或等于6.4;操作②的目的是洗涤氢氧化铜表面的可溶性杂质.
(5)抽Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制Cu2+的水解,防止CuCl2晶体中含有Cu(OH)2杂质.


